
 今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下)另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.
今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下)另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.分析 (1)7.56g混合物中n(碳酸盐)=n(CO2)=$\frac{1.344L}{22.4L/mol}$=0.06mol,由图象可知,当加入0.012 LHCl无CO2生成,发生反应为CO32-+H+=HCO3-,由此知碱金属碳酸盐中n(CO32-)=0.25mol/L×0.012L×10=0.03mol,标况下112mL二氧化碳的物质的量为:n(CO2)=$\frac{0.112L}{22.4L/mol}$=0.05mol,
则原溶液中含有碳酸氢根离子的物质的量为:n(HCO3-)=0.05mol-0.03mol=0.02mol,
设碱金属两种盐中碱金属元素相对原子质量为x,y,列式得出碱金属元素原子量关系式,然后结合碱金属元素的原子量进行判断即可;
(2)碱土金属碳酸盐的物质的量=n(碳酸盐)-n(K2CO3)-n(KHCO3)=0.06mol-0.05mol=0.01mol,则该碱土金属的碳酸盐的摩尔质量为:M=$\frac{1.42g}{0.01mol}$=142g/mol,该0.01mol不溶性碳酸盐消耗盐酸的物质的量为:2.500mol/L×0.01L=0.04mol,而正盐最多消耗0.02molHCl,
所以该该碱土金属的碳酸盐为碱式碳酸盐,设其化学式为:N2(OH)2CO3,结合其摩尔质量计算出N即可.
解答 解:(1)7.56g混合物中n(碳酸盐)=n(CO2)=$\frac{1.344L}{22.4L/mol}$=0.06mol,
由图象可知,当加入0.012 LHCl无CO2生成,发生反应为CO32-+H+=HCO3-,由此知碱金属碳酸盐中n(CO32-)=0.25mol/L×0.012L×10=0.03mol,
标况下112mL二氧化碳的物质的量为:n(CO2)=$\frac{0.112L}{22.4L/mol}$=0.05mol,
则原溶液中含有碳酸氢根离子的物质的量为:n(HCO3-)=0.05mol-0.03mol=0.02mol,
设碱金属两种盐中碱金属元素相对原子质量为x,y,
则:(2x+60)g/mol×0.03mol+(y+61)g/mol×0.02mol=7.56g-1.420g,
即:3x+y=156,
或(2y+60)g/mol×0.03mol+(x+61)g/mol×0.02mol=7.56g-1.420g
即:x+3y=156,
由碱金属Li、Na、K的相对原子质量分析两式,只有当x=y=39时符合题意,故碱金属为K,其碳酸盐的化学式分别为:K2CO3、KHCO3,
答:这两种碱金属碳酸盐的化学式为K2CO3、KHCO3;
(2)碱土金属碳酸盐的物质的量=n(碳酸盐)-n(K2CO3)-n(KHCO3)=0.06mol-0.05mol=0.01mol,
则该碱土金属的碳酸盐的摩尔质量为:M=$\frac{1.42g}{0.01mol}$=142g/mol,
该0.01mol不溶性碳酸盐消耗盐酸的物质的量为:2.500mol/L×0.01L=0.04mol,而正盐最多消耗0.02molHCl,
所以该该碱土金属的碳酸盐为碱式碳酸盐,设其化学式为:N2(OH)2CO3,则:2N=(142-60-17×2),解得:N=24,为Mg元素,
所以该不溶性碳酸盐的化学式为:Mg2(OH)2CO3,
答:原不溶性碳酸盐的化学式为Mg2(OH)2CO3.
点评 本题考查了讨论法在化学计算中的应用、混合物反应的计算,题目难度较大,明确发生反应实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题侧重考查学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>H2Se>HBr | B. | 还原性:Se2->S2->Cl- | ||
| C. | 原子半径:Se>Cl>P | D. | 酸性:H2SeO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
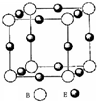 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
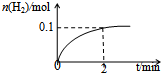 化学平衡:
化学平衡:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
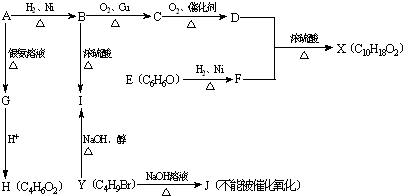
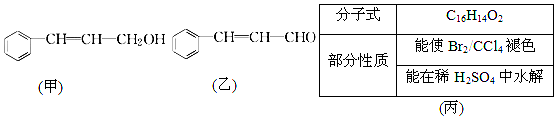
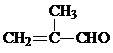 ;J的结构简式为
;J的结构简式为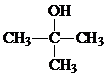 .
.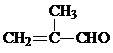 +2[Ag(NH3)2]OH→CH2=C(CH3)COONH4+2Ag↓+3NH3+H2O.
+2[Ag(NH3)2]OH→CH2=C(CH3)COONH4+2Ag↓+3NH3+H2O.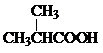 +
+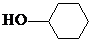 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$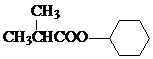 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
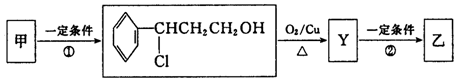
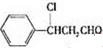 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$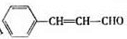 +NaCl+H2O(注明反应条件).
+NaCl+H2O(注明反应条件).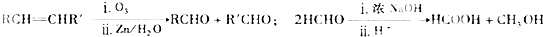
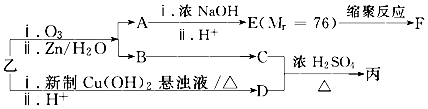
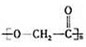 .
.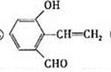 .
.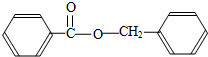 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com