
从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )
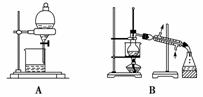
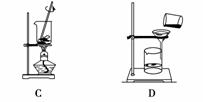
A.放出碘的苯溶液 B.分离碘并回收苯
C.将海带灼烧成灰 D.过滤得含I-溶液
科目:高中化学 来源: 题型:
是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。
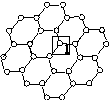

(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________。
(2)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
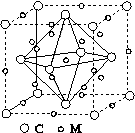
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置:
(1)若烧杯中溶液为稀硫酸,则观察到的现象
为: 。
两极反应式为:
正极 ;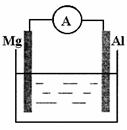
负极 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中属于纯净物的是
①由同种元素组成的物质 ②具有固定熔沸点的物质 ③由相同种类和相同数目的原子组成的分子 ④只有一种元素的阳离子和另一种元素的阴离子组成的物质 ⑤在氧气中燃烧只生成二氧化碳的物质 ⑥只含有一种分子的物质
A.②③⑥ B.④⑤⑥
C.①④ D.②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧燃料电池以KOH溶液为电解质溶液,下列有关该电池的叙述不正确的是
( )
A.正极反应式为:O2+2H2O+4e-===4OH-
B.工作一段时间后,电解液中KOH的物质的量浓度不变
C.该燃料电池的总反应方程式为:2H2+O2===2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.4 mol 电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
以“创新·未来”为主题的第十四届上海国际车展在浦东新国际博览中心举行。车展期间,新一代电动汽车因其“技术含量高”“节能环保”而倍受关注。液态锂离子电池是一种被采用的车载电池,该电池的电极反应如下:正极6C+xLi++xe-===LixC6,负极LiNiO2-xe-===Li1-xNiO2+xLi+。则有关该电池的下列说法中正确的是( )
A.放电时,电子从正极流向电源的负极
B.放电时,Li+向负极移动
C.该电池的总反应为LiNiO2+6C Li1-xNiO2+LixC6
Li1-xNiO2+LixC6
D.充电时,阳极发生的电极反应为Li1-xNiO2+xLi++xe-===LiNiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
物质发生化学反应都伴随着能量变化
伴有能量变化的物质变化都是化学变化
在一个化学反应中,反应物的总能量与生成物的总能量一定相同
D、在一个化学反应中,反应物的总能量一定高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应如下:
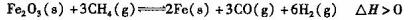
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________ 。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是 ________________(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺 流程如下:试回答下列问题:
流程如下:试回答下列问题:
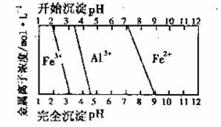
(3)结合下图,判断步骤ⅱ中调节溶液的pH范围_________________。
(4)写出步骤2中发生反应的离子方程式_____________________________,步骤2中分离出的滤渣的化学式是_________________。
(5)已知

 计算 的平衡常数为_____。
计算 的平衡常数为_____。
(6)在空气中煅烧FeCO3生成氧化铁的化学方程式为____________。
(7)结合所学化学知识,请你设计在实验室里从上述的硫铁矿烧渣中提取氧化铁的另一种简单方案_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com