
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)N2(g)+3H2(g)2NH3(g) △H<0,研究表明金属催化剂可加速氨气的合成。下表为某温度下等质量的不同金属分别催化合成氨气时,氢气的初始速率(mmol min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,合成氨气反应的活化能最大的是_______ (填写催化剂的化学式)。
②某研究小组进一步探究催化剂对合成氨气的影响。将N2和H2以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NH3含量,如下图,从而确定温度对催化剂的影响。a点___ (填“是”或“不是”)对应温度下氨气平衡时的百分含量,说明其理由___。

(2)氨气的分解反应2NH3N2+3H2 △H<0,,在实际生产中往刚性容器中同时通入氨气和水蒸气,测得容器总压和氨气转化率随时间变化结果如图所示。

①平衡时,p(H2O)= ___kPa,平衡常数Kp=_____KPa2(Kp为以分压表示的平衡常数)。
②反应速率v=v正-v逆=K正p2(NH3)-K逆p(N2)p3(H2),k正、k逆分别为正、逆反应速率常数。计算a处的![]() =__。
=__。
(3)液氨中,2NH3(l)NH2-+NH4+,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应______。
(4)在室温下用氨水吸收SO2。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的 =____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
=____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
【答案】Fe 不是 该反应是放热反应,根据线Ⅱ可知,a点对应温度下的氨气的平衡体积分数会更高 80 168.75 8100 2NH3+2e-=H2+2NH2-或2NH4++2e-=H2↑+2NH3 0.62
【解析】
(1)①反应的活化能越高,则反应中活化分子数越少,反应速率越慢,则合成氨气反应的速率最慢的反应中,合成氨气反应的活化能最大,即当Fe作催化剂时活化能最大,
故答案为:Fe;
②该反应是放热反应,根据线Ⅱ可知,a点对应温度下的氨气的平衡体积分数会更高,a点不是对应温度下氨气平衡时的百分含量;
(2) ①反应开始总压强为100,反应达到平衡时增大为110,增大了10,说明氨气反应了10,由于氨气的转化率为50%,因此反应开始时氨气的含量为![]() =20%,故水蒸气占80%;p(H2O)=80kPa;根据上述分析可知:平衡时n(NH3)=20-10=10,n(N2)=5,n(H2)=15,则根据平衡常数的含义,物质的量的比等于气体的压强比,因此用平衡分压表示的平衡常数Kp=
=20%,故水蒸气占80%;p(H2O)=80kPa;根据上述分析可知:平衡时n(NH3)=20-10=10,n(N2)=5,n(H2)=15,则根据平衡常数的含义,物质的量的比等于气体的压强比,因此用平衡分压表示的平衡常数Kp=![]() =168.75;
=168.75;
②可逆反应2NH3N2+3H2达到平衡时,正反应速率与逆反应速率相等,此时氨气为10,氮气为5,氢气为15,v=v正-v逆=K正p2(NH3)-K逆p(N2)p3(H2),![]() =
=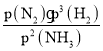 =
=![]() =168.75,在a点时压强为108,则说明此时氨气、氮气、氢气分别为12、4、12,所以
=168.75,在a点时压强为108,则说明此时氨气、氮气、氢气分别为12、4、12,所以![]() =
=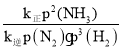 =
=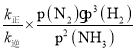 =
=![]() =8100;
=8100;
(3)阴极上氨气或铵根离子得电子发生还原反应,电极反应式为2NH3+2e-=H2+2NH2- 或2NH4++2e-=H2↑+2NH3;
(4)将含SO2的烟气通入该氨水中,当溶液显中性时,c(H+)=c(OH-)=10-7mol/L,Ka2(H2SO3)=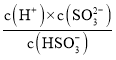 ,
, =
= =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列物质的化学用语表达正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 羟基的电子式:![]()
C. 甲醇的球棍模型:![]() D. 乙酸的实验式:CH3COOH
D. 乙酸的实验式:CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2 O2(g)═SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)═3/2 S2(g)+2H2O(g) △H2
H2S(g)+1/2 O2(g)═S(g)+H2O(g) △H3
2S(g)═S2(g) △H4
则△H4的正确表达式为( )
A.△H4=3/2(△H1-△H2-3△H3)B.△H4=2/3 (3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)D.△H4=2/3 (△H1+△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。若生成0.5molN2,下列说法不正确的是( )
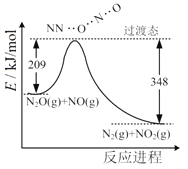
A.反应生成1molN2时转移4mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是5种元素的相关信息,W、X都位于第三周期。
元素 | 信息 |
Q | 地壳中含量最高的元素 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色试验(透过蓝色钴玻璃)火焰呈紫色 |
Z | 原子结构示意图为: |
(1)Q在周期表中的位置是__。
(2)W的最高价氧化物对应的水化物的化学式是___。
(3)X单质与水反应的离子方程式是__。
(4)金属性Y强于X,用原子结构解释原因:__,失电子能力Y大于X,金属性Y强于X。
(5)下列对于Z及其化合物的推断中,正确的是__(填字母)。
A.Z的最低负化合价与W的最低负化合价相同
B.Z的氢化物的稳定性弱于W的氢化物的稳定性
C.Z的单质可与X和W形成的化合物的水溶液发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持装置已略)。
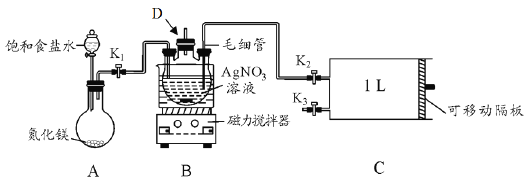
I.配制银氨溶液
(1)盛装AgNO3溶液的仪器D的名称_________。
(2)关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到D中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出A装置中发生反应的化学方程式____;饱和食盐水的用途是_______。
(3)已知银氨溶液的成分是Ag(NH3)2OH,写出D中生成银氨溶液的化学方程式_________ 。
II.测定室内空气中甲醛含量
(4)用热水浴加热D,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是___________。共计进行上述操作十次。
(5)装置中毛细管的作用是_____________ 。
(6)已知甲醛被银氨溶液氧化的化学方程式为HCHO+4Ag(NH3)2OH=(NH4)2CO3+4Ag↓+6NH3↑+2H2O,测得共生成Ag 2.16mg。则空气中甲醛的含量为________mg L-1(空气中其它物质不与银氨溶液反应)。
(7)该设计装置存在一个明显的不足之处是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )
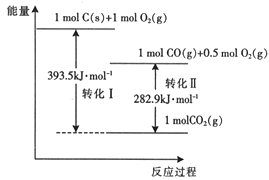
A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1
B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量
C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸和![]() 制
制![]() ,并以干燥的
,并以干燥的![]() 为原料进行实验,装置如下图所示。
为原料进行实验,装置如下图所示。

⑴装置![]() 烧瓶中发生反应的化学方程式为:_________________________________。
烧瓶中发生反应的化学方程式为:_________________________________。
⑵装置![]() 、
、![]() 中应盛放的试剂名称分别为__________、_________;从
中应盛放的试剂名称分别为__________、_________;从![]() 装置导出的气体若不经过
装置导出的气体若不经过![]() 、
、![]() 装置而直接进入
装置而直接进入![]() 管,将对实验产生的不良后果是___________________________。
管,将对实验产生的不良后果是___________________________。
⑶实验时,先点燃![]() 处的酒精灯,让氯气充满装置,再点燃
处的酒精灯,让氯气充满装置,再点燃![]() 处酒精灯,写出
处酒精灯,写出![]() 中反应的化学方程式:_________________________________________。
中反应的化学方程式:_________________________________________。
⑷![]() 装置所起的作用是____________________,____________________。
装置所起的作用是____________________,____________________。
⑸用廉价的石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式:
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为acm,则用上述测定方法测得阿伏加德罗常数NA的表达式为:NA=______mol-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com