

 ��
��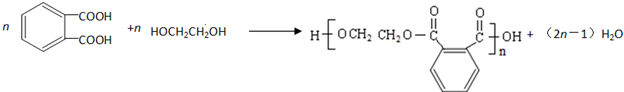 ��
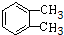
������ �������и����ʵ�ת����ϵ��֪�����CH2=CHCOOH�Ľṹ��CH2=CHCH3����������ȡ����Ӧ����CH2=CHCH2Cl��CH2=CHCH2Cl�ڼ���������ˮ���AΪCH2=CHCH2OH��A��HCl�ӳɿɵ�BΪCH2ClCH2CH2OH��CH3CHClCH2OH��B�еĴ��ǻ��ٱ��������Ȼ���C��D�����������ƵĴ���Һ�н�C����ȥ±����������̼̼˫��������CΪCH2ClCH2COOH��CH3CHClCOOH��DΪCH2=CHCOONa��CH2=CHCOOH��CH3OH��Ӧ����EΪCH2=CHCOOCH3�������Ӿ۷�Ӧ���л���������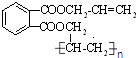 ����֪HΪ
����֪HΪ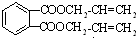 ������GΪ
������GΪ ����FΪ
����FΪ ���ݴ˴��⣮
���ݴ˴��⣮
��� �⣺�������и����ʵ�ת����ϵ��֪�����CH2=CHCOOH�Ľṹ��CH2=CHCH3����������ȡ����Ӧ����CH2=CHCH2Cl��CH2=CHCH2Cl�ڼ���������ˮ���AΪCH2=CHCH2OH��A��HCl�ӳɿɵ�BΪCH2ClCH2CH2OH��CH3CHClCH2OH��B�еĴ��ǻ��ٱ��������Ȼ���C��D�����������ƵĴ���Һ�н�C����ȥ±����������̼̼˫��������CΪCH2ClCH2COOH��CH3CHClCOOH��DΪCH2=CHCOONa��CH2=CHCOOH��CH3OH��Ӧ����EΪCH2=CHCOOCH3�������Ӿ۷�Ӧ���л���������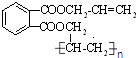 ����֪HΪ
����֪HΪ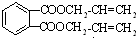 ������GΪ
������GΪ ����FΪ
����FΪ ��
��
��1��������ķ�����֪��BΪCH2ClCH2CH2OH��CH3CHClCH2OH��FΪ ��
��
�ʴ�Ϊ��CH2ClCH2CH2OH��CH3CHClCH2OH�� ��
��
��2��������ķ�����֪����Ӧ��Ϊ��ȥ��Ӧ����Ӧ������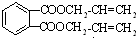 ���ɸ߷ֻ�����
���ɸ߷ֻ�����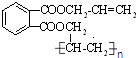 ���ǼӾ۷�Ӧ��
���ǼӾ۷�Ӧ��
�ʴ�Ϊ����ȥ��Ӧ���Ӿ۷�Ӧ��
��3������DAP-A�Ľṹ��ʽ��֪��1molDAP-A��֬��һ�������¿���4nmolH2�����ӳɷ�Ӧ��
�ʴ�Ϊ��4n��
��4����Ӧ�ٵĻ�ѧ����ʽCH2=CHCH3+Cl2$\stackrel{��}{��}$CH2=CHCH2Cl+HCl��
�ʴ�Ϊ��CH2=CHCH3+Cl2$\stackrel{��}{��}$CH2=CHCH2Cl+HCl��
��5��GΪ ��
�� ��һ�����������Ҷ���������Ӧ����һ�ָ߷��ӻ�����Ļ�ѧ����ʽΪ
��һ�����������Ҷ���������Ӧ����һ�ָ߷��ӻ�����Ļ�ѧ����ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��6��EΪCH2=CHCOOCH3����E��ͬ���칹���У������������״�л��ﹲ��4�֣��������Ѿ�������HCOOCH2-CH=CH2��HCOOCH=CH-CH3�������ֵĽṹ��ʽΪHCOOC��CH3��=CH��CH3COOCH=CH2��
�ʴ�Ϊ��HCOOC��CH3��=CH2��CH3COOCH=CH2��
���� ���⿼���л���Ľṹ�����ʣ�ע������л���Ĺ������жϿ��ܾ��е����ʣ�����ʱע����������Ϣ�������л���ı仯д����Ӧ�Ļ�ѧ����ʽ�ǽ�����Ĺؼ����е��Ѷȣ�


 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
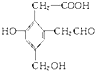 ��ȡ������Na��NaOH������Cu��OH��2�ֱ�������ʵ�����A��һ�������³�ַ�Ӧʱ���������� Na��NaOH������Cu��OH��2�������ʵ����ʵ���֮��Ϊ3��2��3��
��ȡ������Na��NaOH������Cu��OH��2�ֱ�������ʵ�����A��һ�������³�ַ�Ӧʱ���������� Na��NaOH������Cu��OH��2�������ʵ����ʵ���֮��Ϊ3��2��3���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ξ���������ƹ��Ȳ������� | |
| B�� | ��ͭ���м���ϡ���ᣬͭ�۲��ܽ⣻�ټ���Cu��NO3��2���壬ͭ���ܽ� | |
| C�� | ��ͨ�������ɴ��ʯ��ʯ��ʯӢɰ�Ƴɵģ����۵�ܸ� | |
| D�� | ����������ͨ����ˮ����ˮ��ɫ����Ȳ��ָܻ�ԭɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������������Һ��Ӧ����NaCOOH | |
| B�� | ������ˮ����ֽ������AgNO3��Һ | |
| C�� | ����NaOH��Һ�����Ⱥ��ټ���ϡ�����ữ��Ȼ�����AgNO3��Һ | |
| D�� | ����NaOH���Ҵ���Һ�����Ⱥ��ټ���AgNO3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | |
| D | E | F |
| A�� | D�ĵ����dz����İ뵼����� | |
| B�� | B��E�γɵĻ����ﲻֻһ�� | |
| C�� | C��F��ԭ������֮��Ϊ8 | |
| D�� | A������������ˮ�����ܺ�Al��OH��3��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
�� ��D��E�γɵĻ����
��D��E�γɵĻ����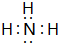 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
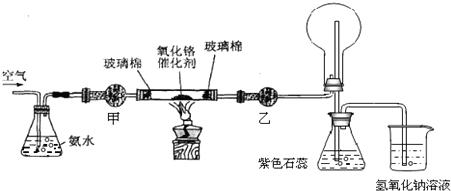
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼��� ���� ���Լ� | |
| B�� | �ռ� ������������ ������CuSO4•5H2O�� | |
| C�� | ���� ����ͭ��Һ ����ͭ | |
| D�� | ��ʯ�� �̷���FeSO4•7H2O�� ʯ��ʯ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com