
”¾ĢāÄæ”æĪŖĮĖŗĻĄķĄūÓĆ»ÆѧÄÜ£¬Č·±£°²Č«Éś²ś£¬»Æ¹¤Éč¼ĘŠčŅŖ³ä·Öæ¼ĀĒ»Æѧ·“Ó¦µÄ·“Ó¦ČČ£¬²¢²ÉČ”ĻąÓ¦“ėŹ©£®»Æѧ·“Ó¦µÄ·“Ó¦ČČĶس£ÓĆŹµŃé½ųŠŠ²ā¶Ø£¬Ņ²æɽųŠŠĄķĀŪĶĘĖć£®
£Ø1£©ŹµŃé²āµĆ£¬5g¼×“¼£ØCH3OH£©ŅŗĢåŌŚŃõĘųÖŠ³ä·ÖČ¼ÉÕÉś³É¶žŃõ»ÆĢ¼ĘųĢåŗĶŅŗĢ¬Ė®Ź±ŹĶ·Å³ö113.5kJµÄČČĮ棬Ōņ±ķŹ¾¼×“¼±ź×¼Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ__________£®
£Ø2£©½ńÓŠČēĻĀĮ½øöČČ»Æѧ·½³ĢŹ½£ŗŌņa______b£ØĢī”°£¾”±”¢”°=”±»ņ”°£¼”±£©
H2£Øg£©+![]() O2£Øg£©=H2O£Øg£©”÷H1=akJmol-1
O2£Øg£©=H2O£Øg£©”÷H1=akJmol-1
H2£Øg£©+![]() O2£Øg£©=H2O£Øl£©”÷H2=bkJmol-1
O2£Øg£©=H2O£Øl£©”÷H2=bkJmol-1
£Ø3£©²šæŖ1molĘųĢ¬ĪļÖŹÖŠÄ³ÖÖ¹²¼Ū¼üŠčŅŖĪüŹÕµÄÄÜĮ潊¼üÄÜ£®“Ó»Æѧ¼üµÄ½Ē¶Č·ÖĪö£¬»Æѧ·“Ó¦µÄ¹ż³Ģ¾ĶŹĒ·“Ó¦ĪļµÄ»Æѧ¼üµÄĘĘ»µŗĶÉś³ÉĪļµÄ»Æѧ¼üµÄŠĪ³É¹ż³Ģ£®ŌŚ»Æѧ·“Ó¦¹ż³ĢÖŠ£¬²šæŖ»Æѧ¼üŠčŅŖĻūŗÄÄÜĮ棬ŠĪ³É»Æѧ¼üÓÖ»įŹĶ·ÅÄÜĮ森
»Æѧ¼ü | H-H | N-H | N”ŌN |
¼üÄÜ/kJmol-1 | 436 | 391 | 945 |
ŅŃÖŖ·“Ó¦N2£Øg£©+3H2£Øg£©=2NH3£Øg£©”÷H=akJmol-1£®ŹŌøł¾Ż±ķÖŠĖłĮŠ¼üÄÜŹż¾Ż¹ĄĖćaµÄÖµ£ŗ____________£Ø×¢Ć÷”°+”±»ņ”°-”±£©£®
£Ø4£©ŅĄ¾ŻøĒĖ¹¶ØĀÉæÉŅŌ¶ŌijŠ©ÄŃŅŌĶعżŹµŃéÖ±½Ó²ā¶ØµÄ»Æѧ·“Ó¦µÄ·“Ó¦ČČ½ųŠŠĶĘĖć£®ĄūÓĆĖ®ĆŗĘųŗĻ³É¶ž¼×ĆѵÄČż²½·“Ó¦ČēĻĀ£ŗ
¢Ł2H2£Øg£©+CO£Øg£©=CH3OH£Øg£©£»”÷H=-90.8kJmol-1
¢Ś2CH3OH£Øg£©=CH3OCH3£Øg£©+H2O£Øg£©£»”÷H=-23.5kJmol-1
¢ŪCO£Øg£©+H2O£Øg£©=CO2£Øg£©+H2£Øg£©£»”÷H=-41.3kJmol-1
×Ü·“Ó¦£ŗ3H2£Øg£©+3CO£Øg£©=CH3OCH3£Øg£©+CO2£Øg£©µÄ”÷H=________________£®
£Ø5£©Ęū³µĪ²ĘųĄļŗ¬ÓŠµÄNOĘųĢåŹĒÓÉÓŚÄŚČ¼»śČ¼ÉÕµÄøßĪĀŅżĘšµŖĘųŗĶŃõĘų·“Ó¦ĖłÖĀ£ŗN2£Øg£©+O2£Øg£©2NO£Øg£©”÷H£¾0£¬ŅŃÖŖøĆ·“Ó¦ŌŚ2 404”ę£¬Ę½ŗā³£ŹżK=64”Į10©4£®Ēė»Ų“š£ŗ
¢Ł½«N2”¢O2µÄ»ģŗĻĘųĢå³äČėŗćĪĀŗćČŻĆܱÕČŻĘ÷ÖŠ£¬ČēĶ¼±ä»ÆĒ÷ŹĘÕżČ·µÄŹĒ_____£ØĢī×ÖÄøŠņŗÅ£©£®
¢ŚøĆĪĀ¶ČĻĀ£¬Ä³Ź±æĢ²āµĆČŻĘ÷ÄŚN2”¢O2”¢NOµÄÅØ¶Č·Ö±šĪŖ2.5”Į10©1 mol/L”¢4.0”Į10©2 mol/LŗĶ3.0”Į10©3 mol/L£¬“ĖŹ±·“Ó¦_______£ØĢī”°“¦ÓŚ»ÆŃ§Ę½ŗāדĢ¬”±”¢”°ĻņÕż·“Ó¦·½Ļņ½ųŠŠ”±»ņ”°ĻņÄę·“Ó¦·½Ļņ½ųŠŠ”±£©£¬ĄķÓÉŹĒ_______£®
”¾“š°ø”æCH3OH£Øg£©+![]() O2£Øg£©=CO2£Øg£©+2H2O£Øl£© ”÷H=-726.4KJ/mol £¾ -93 -246.4kJmol-1 AC ĻņÕż·“Ó¦·½Ļņ½ųŠŠ ŅņĪŖQc=
O2£Øg£©=CO2£Øg£©+2H2O£Øl£© ”÷H=-726.4KJ/mol £¾ -93 -246.4kJmol-1 AC ĻņÕż·“Ó¦·½Ļņ½ųŠŠ ŅņĪŖQc= £¼64”Į10©4£¬ĖłŅŌ·“Ó¦ĻņÕż·“Ó¦·½Ļņ½ųŠŠ
£¼64”Į10©4£¬ĖłŅŌ·“Ó¦ĻņÕż·“Ó¦·½Ļņ½ųŠŠ
”¾½āĪö”æ
£Ø1£©øł¾Ż5g¼×“¼·“Ó¦·Å³öµÄČČĮæ¼ĘĖć1mol¼×“¼·“Ó¦·Å³öµÄČČĮ棬Š“³öÕżČ·µÄČČ»Æѧ·½³ĢŹ½£»
£Ø2£©Į½øö·½³ĢŹ½ÖŠĖ®µÄדĢ¬²»Ķ¬£¬¶ųĘųĢ¬Ė®±äĪŖŅŗĢ¬Ė®·Å³öČČĮ棬¾Ż“ĖÅŠ¶Ļ£»
£Ø3£©øł¾Ż”÷H=·“Ó¦ĪļµÄ×ܼüÄÜ-Éś³ÉĪļµÄ×ܼüÄܽųŠŠ¼ĘĖć£»
£Ø4£©øł¾ŻøĒĖ¹¶ØĀɽųŠŠ¼ĘĖć£»
£Ø5£©øł¾ŻĪĀ¶Č”¢“߻ƼĮ¶Ō·“Ó¦ĖŁĀŹŗĶĘ½ŗāŅĘ¶ÆµÄÓ°Ļģ½ųŠŠÅŠ¶Ļ£»
£Ø1£©5g¼×“¼·“Ó¦·Å³öµÄČČĮæĪŖ113.5kJ£¬¼ĘĖćµĆ32g¼×“¼·“Ó¦·Å³öµÄČČĮæĪŖ726.4kJ£¬ČČ»Æѧ·½³ĢŹ½ĪŖCH3OH£Øg£©+![]() O2£Øg£©=CO2£Øg£©+2H2O£Øl£© ”÷H=-726.4KJ/mol£»
O2£Øg£©=CO2£Øg£©+2H2O£Øl£© ”÷H=-726.4KJ/mol£»
£Ø2£©Į½øö·½³ĢŹ½ÖŠĖ®µÄדĢ¬²»Ķ¬£¬¶ųĘųĢ¬Ė®±äĪŖŅŗĢ¬Ė®·Å³öČČĮ棬b·“Ó¦·Å³öµÄČČĮæ±Ča¶ą£¬ÓÖŅņa”¢b¶¼ŹĒøŗŹż£¬ŌņÓŠa£¾b£»
£Ø3£©”÷H=·“Ó¦ĪļµÄ×ܼüÄÜ-Éś³ÉĪļµÄ×ܼüÄÜ=945 kJ/mol+3”Į436 kJ/mol-2”Į3”Į391 kJ/mol
=-93 kJ/mol£¬¼“a=- 93£»
ÓÉøĒĖ¹¶ØĀÉÓŠ2”Į¢Ł+¢Ś+¢Ū£¬”÷H=-90.8kJmol-1”Į2+£Ø-23.5kJmol-1£©+£Ø-41.3kJmol-1£©=-246.4 kJmol-1£»
£Ø5£©A. ¢ŁÓÉ·“Ó¦N2£Øg£©+O2£Øg£©2NO£Øg£©”÷H£¾0£¬æÉÖŖ£¬øĆ·“Ó¦ĪŖĪüČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāÕżŅĘ£¬KÖµŌö“ó£¬AĻīÕżČ·£»
B.·“Ó¦ÖŠ¼ÓČė“߻ƼĮ£¬·“Ó¦ĖŁĀŹŌö“󣬵«Ę½ŗā²»ŅĘ¶Æ£¬BĻī“ķĪó£»
C.ĪĀ¶ČÉżøß·“Ó¦ĖŁĀŹŌö“ó£¬Ę½ŗāÕżŅĘ£¬°±ĘųµÄ×Ŗ»ÆĀŹŌö“ó£¬CĻīÕżČ·£»
“š°øŃ”AC”£
¢Ś N2£Øg£©+ O2£Øg£© 2NO£Øg£©£¬Ä³Ź±æĢČŻĘ÷ÄŚN2”¢O2”¢NOµÄÅØ¶Č·Ö±šĪŖ2.5”Į10©1”¢4.0”Į10©2 ”¢3.0”Į10©3 mol/L£¬Qc=![]() £¬¶ųK=64”Į10©4£¬Qc£¼K£¬æÉÖŖĘ½ŗāÕżĻņŅĘ¶Æ”£
£¬¶ųK=64”Į10©4£¬Qc£¼K£¬æÉÖŖĘ½ŗāÕżĻņŅĘ¶Æ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŠæ”¢Ģś”¢Ķ¼°Ęä»ÆŗĻĪļŌŚÉś»ī”¢Éś²śÖŠÓŠ×Źć·ŗÓ¦ÓĆ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)»łĢ¬Fe3£«µÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ____________”£ŌŚµŚĖÄÖÜĘŚ¹ż¶ÉŌŖĖŲÖŠ£¬»łĢ¬Ō×ÓĪ“³É¶Ōµē×ÓŹż×ī¶ąµÄŌŖĖŲĪŖ____________(ÓĆŌŖĖŲ·ūŗűķŹ¾)”£
(2)Ņ»Ė®ŗĻøŹ°±ĖįŠæ[(H2NCH2COO)2Zn”¤H2O]ŹĒŅ»ÖÖĖĒĮĻĢķ¼Ó¼Į£¬øĆ»ÆŗĻĪļÖŠĖłÉę¼°µÄ·Ē½šŹōŌŖĖŲµēøŗŠŌÓɓ󵽊”µÄĖ³ŠņŹĒ____________(ÓĆŌŖĖŲ·ūŗűķŹ¾)£»øŹ°±Ėį·Ö×ÓÖŠNŌ×ÓµÄŌӻƹģµĄĄąŠĶĪŖ____________£»“Ó½į¹¹½Ē¶Č½āŹĶøŹ°±ĖįŅ×ČÜÓŚĖ®µÄŌŅņ£ŗ________________”£
(3)ĶŌŖĖŲµÄµŚŅ»µēĄėÄÜ”¢µŚ¶žµēĄėÄÜ·Ö±šĪŖ746 kJ”¤mol£1”¢1958 kJ”¤mol£1£»ŠæŌŖĖŲµÄµŚŅ»µēĄėÄÜ”¢µŚ¶žµēĄėÄÜ·Ö±šĪŖ906 kJ”¤mol£1”¢1733 kJ”¤mol£1£¬ĶµÄµŚ¶žµēĄėÄÜ“óÓŚŠæµÄµŚ¶žµēĄėÄÜ£¬ĘäÖ÷ŅŖŌŅņŹĒ___________________________________________________”£
(4)Į×ĖįĢś(FePO4)æÉÓĆÓŚÖĘŌģĮ×ĖįĢśļ®µē³Ų²ÄĮĻ£¬PO![]() µÄæռ乹ŠĶĪŖ______________”£
µÄæռ乹ŠĶĪŖ______________”£
(5)ijÖÖ»ÆŗĻĪļÓÉFe”¢Cu”¢SČżÖÖŌŖĖŲ×é³É£¬Ę侧°ū½į¹¹ČēĶ¼ĖłŹ¾£¬Ōņ»ÆѧŹ½ĪŖ__________£¬øĆ¾§°ūÉĻ”¢ĻĀµ×Ćę¾łĪŖÕż·½ŠĪ£¬²ąĆęÓėµ×Ćę“¹Ö±£¬ČōøĆ¾§ĢåµÄĆÜ¶Č¦Ń g”¤cm£3£¬ÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬½įŗĻĶ¼ÖŠµÄŹż¾Ż¼ĘĖćµ×ĆęĄā³¤a£½____________(Ö»ŅŖĒóĮŠ³ö¼ĘĖćŹ½£¬ÓĆŗ¬bµÄ“śŹżŹ½±ķŹ¾)pm”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖ“ļµ½ĻĀĮŠŹµŃéÄæµÄ£¬¶ŌÓ¦µÄŹµŃé·½·ØŅŌ¼°Ļą¹Ų½āŹĶ¾łÕżČ·µÄŹĒ
Ń”Ļī | ŹµŃéÄæµÄ | ŹµŃé·½·Ø | Ļą¹Ų½āŹĶ |
A | ²āĮæĀČĖ®µÄpH |
| pHŹŌÖ½ÓöĖį±äŗģ |
B | Ģ½¾æÕżĪģĶéC5H12“ß»ÆĮŃ½ā |
| C5H12ĮŃ½āĪŖ·Ö×Ó½ĻŠ”µÄĶéĢžŗĶĻ©Ģž |
C | ŹµŃéĪĀ¶Č¶ŌĘ½ŗāŅĘ¶ÆµÄÓ°Ļģ |
| 2NO2 |
D | ÓĆAlCl3ČÜŅŗÖʱøAlCl3¾§Ģå |
| AlCl3·ŠµćøßÓŚČܼĮĖ® |
A.AB.BC.CD.D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©Ēė°“ÕÕĻµĶ³ĆüĆū·ØĪŖĻĀĮŠĪļÖŹĆüĆū£ŗ
 ___
___
![]() ___
___
![]() ___
___
£Ø2£©ĒėŠ“³ö2£¬3”Ŗ¶ž¼×»ł”Ŗ4”ŖŅŅ»ł”Ŗ2”ŖøżĻ©µÄ½į¹¹¼ņŹ½£ŗ___£»
£Ø3£©ĒėŠ“³öÓɱ½ÖʱøĻõ»ł±½µÄ»Æѧ·“Ó¦·½³ĢŹ½___”£
£Ø4£©Ä³æĪĢā×é“ÓÖ²ĪļĻćĮĻÖŠ·ÖĄė³öŅ»ÖÖŗ±¼ūµÄ“¼£Ø“¼A£©£¬Ęä½į¹¹¼ņŹ½ČēĶ¼”£

øł¾ŻæĪÄŚĖłŃ§ÖŖŹ¶£¬øĆ“¼æÉ·¢ÉśµÄ·“Ó¦°üĄØ£ŗ___£ØĢī×ÖÄøŠņŗÅ£©
A.Óė½šŹōNa·“Ó¦ B.ÓėCuO·“Ó¦
C.ÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦ D.ĻūČ„·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖę×ÅŹ±“śµÄ·¢Õ¹£¬ĀĢÉ«»·±£ĄķÄīŌ½Ą“Ō½ŹÜµ½“ó¼ŅµÄČĻĶ¬£¬±ä·ĻĪŖ±¦ŹĒĪŅĆĒĆæŅ»Ī»¹«ĆńÓ¦øĆŃų³ÉµÄŅāŹ¶”£Ä³Ķ¬Ń§³¢ŹŌÓĆ·Ļ¾ÉµÄĀĮÖĘŅץ¹Ž×÷ĪŖŌ²ÄĮĻ”¢²ÉÓĆ”°ĒāŃõ»ÆĀĮ·Ø”±ÖĘČ”Ć÷·Æ¾§Ģå²¢½ųŠŠŅ»ĻµĮŠµÄŠŌÖŹĢ½¾æ”£
ÖĘČ”Ć÷·Æ¾§ĢåÖ÷ŅŖÉę¼°µ½ŅŌĻĀĖÄøö²½Öč£ŗ
µŚŅ»²½£ŗĀĮÖĘĘ·µÄČܽā”£Č”Ņ»¶ØĮæĀĮÖĘĘ·£¬ÖĆÓŚ250mL׶ŠĪĘæÖŠ£¬¼ÓČėŅ»¶ØÅضČŗĶĢå»żµÄĒæ¼īČÜŅŗ£¬Ė®Ō”¼ÓČČ(Ō¼93”ę)£¬“ż·“Ó¦ĶźČ«ŗó(²»ŌŁÓŠĒāĘųÉś³É)£¬³ĆČČ¼õŃ¹³éĀĖ£¬ŹÕ¼ÆĀĖŅŗÓŚ250mLÉÕ±ÖŠ£»
µŚ¶ž²½£ŗĒāŃõ»ÆĀĮ³ĮµķµÄÉś³É”£½«ĀĖŅŗÖŲŠĀÖĆÓŚĖ®Ō”¹ųÖŠ£¬ÓĆ3 mol/L H2SO4µ÷½ŚĀĖŅŗpHÖĮ8”«9£¬µĆµ½²»ČÜŠŌ°×É«ŠõĿדAl(OH)3£¬¼õŃ¹³éĀĖµĆµ½³Įµķ£»
µŚČż²½£ŗĮņĖįĀĮČÜŅŗµÄÉś³É”£½«³Įµķ×ŖŅĘÖĮ250mLÉÕ±ÖŠ£¬±ß¼ÓČȱߵĪČėŅ»¶ØÅضČŗĶĢå»żµÄH2SO4ČÜŅŗ£»
µŚĖIJ½£ŗĮņĖįĀĮ¼ŲČÜŅŗµÄŠĪ³É”£“ż³ĮµķČ«²æČܽāŗó¼ÓČėŅ»¶ØĮæµÄ¹ĢĢåK2SO4£¬½«µĆµ½µÄ±„ŗĶ³ĪĒåČÜŅŗĄäČ“½µĪĀÖ±ÖĮ¾§ĢåČ«²æĪö³ö£¬¼õŃ¹³éĀĖ”¢Ļ“µÓ”¢³éøÉ£¬»ńµĆ²śĘ·Ć÷·Æ¾§Ģå[KAl(SO4)2”¤12H2O£¬M£½474g/mol]”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)µŚŅ»²½ĀĮµÄČܽā¹ż³ĢÖŠÉę¼°µ½µÄÖ÷ŅŖ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________________________
(2)ĪŖĮĖ¼ÓæģĀĮÖĘĘ·µÄČܽā£¬Ó¦øƶŌĀĮÖĘĘ·½ųŠŠŌõŃłµÄŌ¤“¦Ąķ£ŗ________________________
(3)µŚĖIJ½²Ł×÷ÖŠ£¬ĪŖĮĖ±£Ö¤²śĘ·µÄ“æ¶Č£¬Ķ¬Ź±ÓÖ¼õÉŁ²śĘ·µÄĖšŹ§£¬Ó¦Ń”ŌńĻĀĮŠČÜŅŗÖŠµÄ___(ĢīŃ”Ļī×ÖÄø)½ųŠŠĻ“µÓ£¬ŹµŃ銧¹ū×ī¼Ń”£
A.ŅŅ“¼ B.±„ŗĶK2SO4ČÜŅŗ C.ÕōĮóĖ® D.1£ŗ1ŅŅ“¼Ė®ČÜŅŗ
(4)ĪŖĮĖ²ā¶ØĖłµĆĆ÷·Æ¾§ĢåµÄ“æ¶Č£¬½ųŠŠČēĻĀŹµŃé²Ł×÷£ŗ×¼Č·³ĘČ”Ć÷·Æ¾§ĢåŹŌŃł4.0gÓŚÉÕ±ÖŠ£¬¼ÓČė50mL 1mol/LŃĪĖį½ųŠŠČܽā£¬½«ÉĻŹöČÜŅŗ×ŖŅĘÖĮ100mLČŻĮæĘæÖŠ£¬Ļ”ŹĶÖĮæĢ¶ČĻߣ¬Ņ”ŌČ£»ŅĘČ”25.00 mLČÜŅŗøÉ250 mL׶ŠĪĘæÖŠ£¬¼ÓČė30 mL 0.10mol/L EDTA£2Na±ź×¼ČÜŅŗ£¬ŌŁµĪ¼Ó¼øµĪ2D¶ž¼×·Ó³Č£¬“ĖŹ±ČÜŅŗ³Ź»ĘÉ«£»¾¹żŗóŠųŅ»ĻµĮŠ²Ł×÷£¬×īÖÕÓĆ0.20 mol/LŠæ±ź×¼ČÜŅŗµĪ¶ØÖĮČÜŅŗÓÉ»ĘÉ«±äĪŖ×ĻŗģÉ«£¬“ļµ½µĪ¶ØÖÕµćŹ±£¬¹²ĻūŗÄ5.00 mLŠæ±ź×¼ČÜŅŗ”£µĪ¶ØŌĄķĪŖH2Y2££«Al3£«”śAlY££«2H£«£¬H2Y2£(¹żĮæ)£«Zn2£«”śZnY2££«2H£«(×¢£ŗH2Y2£±ķŹ¾EDTA£2Na±ź×¼ČÜŅŗĄė×Ó)”£ŌņĖłµĆĆ÷·Æ¾§ĢåµÄ“æ¶ČĪŖ_________%”£
(5)Ć÷·Æ³żĮĖæÉŅŌÓĆ×÷ČĖĆĒŹģĻ¤µÄ¾»Ė®¼ĮÖ®Ķā£¬»¹³£ÓĆ×÷²æ·ÖŹ³Ę·µÄÅņĖɼĮ£¬ĄżČēÓĶĢõ(±ż)µÄÖĘ×÷¹ż³ĢŠčŅŖ¼ÓČėŅ»¶ØĮæµÄĆ÷·Æ£¬Ēė¼ņŹöĆ÷·ÆŌŚĆęŹ³ÖĘ×÷¹ż³Ģ×÷ÅņĖɼĮµÄŌĄķ£ŗ_______
(6)ĪŖĮĖĢ½¾æĆ÷·Æ¾§ĢåµÄ½į¾§Ė®ŹżÄæ¼°·Ö½ā²śĪļ£¬ŌŚN2ĘųĮ÷ÖŠ½ųŠŠČČ·Ö½āŹµŃ飬µĆµ½Ć÷·Æ¾§ĢåµÄČČ·Ö½āĒśĻßČēĶ¼ĖłŹ¾(TG%“ś±ķµÄŹĒ·Ö½āŗóŹ£Óą¹ĢĢåÖŹĮæÕ¼ŃłĘ·ŌŹ¼ÖŹĮæµÄ°Ł·ÖĀŹ£¬Ź§ÖŲ°Ł·ÖĀŹ£½![]() ”Į100%)£ŗ
”Į100%)£ŗ
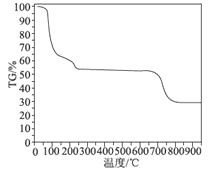
øł¾ŻTGĒśĻß³öĻÖµÄĘ½Ģؼ°Ź§ÖŲ°Ł·ÖĀŹ£¬30”«270”ę·¶Ī§ÄŚ£¬Ź§ÖŲĀŹŌ¼ĪŖ45.57%£¬680”«810”ę·¶Ī§ÄŚ£¬Ź§ÖŲ°Ł·ÖĀŹŌ¼ĪŖ25.31%£¬×ÜŹ§ÖŲĀŹŌ¼ĪŖ70.88%£¬Ēė·Ö±šŠ“³öĖłÉę¼°µ½30”«270”ę”¢680”«810”ęĪĀ¶Č·¶Ī§ÄŚÕāĮ½øö½×¶ĪµÄČČ·Ö½ā·½³ĢŹ½£ŗ___________”¢_____________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©Ä³æĪĶā»ī¶ÆŠ”×éĶ¬Ń§ÓĆČēĶ¼1×°ÖĆ½ųŠŠŹµŃ飬ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁČōæŖ¹ŲKÓėaĮ¬½Ó£¬ŌņĢś·¢Éśµē»ÆѧøÆŹ“ÖŠµÄ______øÆŹ“£¬ŹÆÄ«µē¼«ÉĻµÄµē¼«·“Ó¦Ź½ĪŖ______£®

¢ŚČōæŖ¹ŲKÓėbĮ¬½Ó£¬Ōņµē½ā·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ______£®
£Ø2£©øĆŠ”×éĶ¬Ń§ÉčĻė£¬Čē¹ūÄ£Äā¹¤ŅµÉĻĄė×Ó½»»»Ä¤·ØÖĘÉÕ¼īµÄ·½·Ø£¬ÓĆČē2Ķ¼ĖłŹ¾×°ÖƵē½āĮņĖįÄĘČÜŅŗĄ“ÖĘČ”ĒāĘų”¢ŃõĘų”¢ĮņĖįŗĶĒāŃõ»ÆÄĘ£¬ĪŽĀŪ“Ó½ŚŹ”ÄÜŌ“»¹ŹĒ“ÓĢįøßŌĮĻµÄĄūÓĆĀŹ¶ųŃŌ¶¼øü¼Ó·ūŗĻĀĢÉ«»ÆѧĄķÄī£®
¢ŁøƵē½ā²ŪµÄŃō¼«·“Ó¦Ź½ĪŖ______£®“ĖŹ±ĶعżŅõĄė×Ó½»»»Ä¤µÄĄė×ÓŹż______£ØŃ”Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©ĶعżŃōĄė×Ó½»»»Ä¤µÄĄė×ÓŹż£®
¢ŚĶصēæŖŹ¼ŗó£¬Ņõ¼«ø½½üČÜŅŗpH______£ØŃ”Ģī”°Ōö“ó”±”¢”°²»±ä”±»ņ”°¼õŠ””±£©£®
¢ŪČō½«ÖʵƵÄĒāĘų”¢ŃõĘųŗĶĒāŃõ»ÆÄĘČÜŅŗ×éŗĻĪŖĒāŃõČ¼ĮĻµē³Ų£¬Ōņµē³Ųøŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ______£»ŅŃÖŖH2µÄČ¼ÉÕČČĪŖ285.8KJ/mol£¬ŌņøĆČ¼ĮĻµē³Ų¹¤×÷²śÉś36gŅŗĢ¬H2OŹ±£¬ĄķĀŪÉĻÓŠ______kJµÄÄÜĮæ×Ŗ»ÆĪŖµēÄÜ£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆŠ”Į£¾¶Įć¼ŪĢś(ZVI)µÄµē»ÆѧøÆŹ““¦ĄķČżĀČŅŅĻ©£¬½ųŠŠĖ®Ģ劎ø“µÄ¹ż³ĢČēĶ¼ĖłŹ¾”£H+”¢O2”¢![]() µČ¹²“ęĪļµÄ“ęŌŚ»įÓ°ĻģĖ®Ģ劎ø“Š§¹ū£¬¶ØŅ嵄Ī»Ź±¼äÄŚZVIŹĶ·Åµē×ÓµÄĪļÖŹµÄĮæĪŖnt£¬ĘäÖŠÓĆÓŚÓŠŠ§øÆŹ“µÄµē×ÓµÄĪļÖŹµÄĮæne”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
µČ¹²“ęĪļµÄ“ęŌŚ»įÓ°ĻģĖ®Ģ劎ø“Š§¹ū£¬¶ØŅ嵄Ī»Ź±¼äÄŚZVIŹĶ·Åµē×ÓµÄĪļÖŹµÄĮæĪŖnt£¬ĘäÖŠÓĆÓŚÓŠŠ§øÆŹ“µÄµē×ÓµÄĪļÖŹµÄĮæne”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ

A.·“Ó¦¢Ł¢Ś¢Ū¢Ü¾łŌŚÕż¼«·¢Éś
B.¢ÜµÄµē¼«·“Ó¦Ź½ĪŖ![]() +10H++8e-=
+10H++8e-=![]() +3H2O
+3H2O
C.µ„Ī»Ź±¼äÄŚ£¬ČżĀČŅŅĻ©ĶŃČ„amolClŹ±ne=amol
D.Ōö“óµ„Ī»Ģå»żĖ®ĢåÖŠŠ”Ī¢Į£ZVIµÄĶ¶ČėĮ棬æÉŹ¹ntŌö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµŖµÄŃõ»ÆĪļŹĒ“óĘųĪŪČ¾ĪļÖ®Ņ»£¬ÓĆ»īŠŌĢæ»ņŅ»Ńõ»ÆĢ¼»¹ŌµŖŃõ»ÆĪļ£¬æÉ·ĄÖ¹æÕĘųĪŪČ¾”£»Ų“šĻĀĮŠĪŹĢā£ŗ
ŅŃÖŖ£ŗ2C(s)+O2(g)=2CO(g) ¦¤H=-221 kJ/mol
C(s)+O2(g)=CO2(g) ¦¤H=-393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ¦¤H=+181 kJ/mol
£Ø1£©Čōij·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK=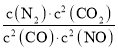 £¬ĒėŠ“³ö“Ė·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ_______£»ĻĀĮŠ“ėŹ©Äܹ»Ōö“ó“Ė·“Ó¦ÖŠNOµÄ×Ŗ»ÆĀŹµÄŹĒ£ØĢī×ÖÄø“śŗÅ£©____________”£
£¬ĒėŠ“³ö“Ė·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ_______£»ĻĀĮŠ“ėŹ©Äܹ»Ōö“ó“Ė·“Ó¦ÖŠNOµÄ×Ŗ»ÆĀŹµÄŹĒ£ØĢī×ÖÄø“śŗÅ£©____________”£
a£®Ōö“óČŻĘ÷Ń¹Ēæ b£®ÉżøßĪĀ¶Č c£®Ź¹ÓĆÓÅÖŹ“߻ƼĮ d£®Ōö“óCOµÄÅضČ
£Ø2£©ĻņČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė»īŠŌĢæ(×ćĮæ)ŗĶNO£¬·¢Éś·“Ó¦C(s)+2NO(g)![]() N2(g)+CO2(g)£¬NOŗĶN2µÄĪļÖŹµÄĮæ±ä»ÆČēĻĀ±ķĖłŹ¾”£
N2(g)+CO2(g)£¬NOŗĶN2µÄĪļÖŹµÄĮæ±ä»ÆČēĻĀ±ķĖłŹ¾”£
ĪļÖŹµÄĮæ/mol | T1/”ę | T2/”ę | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
¢Ł0”«5minÄŚ£¬ŅŌCO2±ķŹ¾µÄøĆ·“Ó¦ĖŁĀŹv(CO2)=______£¬øĆĢõ¼žĻĀµÄĘ½ŗā³£ŹżK=_____”£
¢ŚµŚ15 minŗó£¬ĪĀ¶Čµ÷Õūµ½T2£¬Źż¾Ż±ä»ÆČēÉĻ±ķĖłŹ¾£¬ŌņT1_______T2£ØĢī”°£¾”±”¢”°£¼”±»ņ”°£½”±£©”£
¢ŪČō30minŹ±£¬±£³ÖT2²»±ä£¬ĻņøĆČŻĘ÷ÖŠŌŁ¼ÓČėøĆĖÄÖÖ·“Ó¦»ģŗĻĪļø÷2 mol£¬Ōņ“ĖŹ±·“Ó¦_______ŅĘ¶Æ£ØĢī”°ÕżĻņ”±
£Ø3£©¹¤ŅµÉĻæÉŅŌÓĆ°±Ė®³żČ„·“Ó¦C(s)+2NO(g)![]() N2(g)+CO2(g)ÖŠ²śÉśµÄCO2£¬µĆµ½NH4HCO3ČÜŅŗ£¬·“Ó¦NH4++HCO3-+H2O
N2(g)+CO2(g)ÖŠ²śÉśµÄCO2£¬µĆµ½NH4HCO3ČÜŅŗ£¬·“Ó¦NH4++HCO3-+H2O![]() NH3”¤H2O+H2CO3µÄĘ½ŗā³£ŹżK=____________”££ØŅŃÖŖ³£ĪĀĻĀNH3”¤H2OµÄµēĄėĘ½ŗā³£ŹżKb=2”Į10-5£¬H2CO3µÄµēĄėĘ½ŗā³£ŹżKa1=4”Į10-7£¬Ka2=4”Į10-11£¬Ė®µÄĄė×Ó»ż³£ŹżKw=1”Į10-14£©
NH3”¤H2O+H2CO3µÄĘ½ŗā³£ŹżK=____________”££ØŅŃÖŖ³£ĪĀĻĀNH3”¤H2OµÄµēĄėĘ½ŗā³£ŹżKb=2”Į10-5£¬H2CO3µÄµēĄėĘ½ŗā³£ŹżKa1=4”Į10-7£¬Ka2=4”Į10-11£¬Ė®µÄĄė×Ó»ż³£ŹżKw=1”Į10-14£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠĻĀĮŠ¼ø×éĪļÖŹ£ŗ
A.![]() H”¢D”¢T B£®
H”¢D”¢T B£®![]() C”¢
CӢ![]() CӢ
C”¢![]() C C£®O2”¢O3 D£®½šøÕŹÆÓėŹÆÄ« E£®
C C£®O2”¢O3 D£®½šøÕŹÆÓėŹÆÄ« E£® 
F£®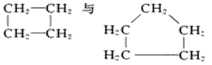 G£®
G£®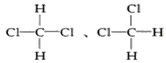
(Ģī¶ŌÓ¦×ÖÄø)
(1)ŹōÓŚĶ¬Ī»ĖŲµÄÓŠ___________________________£»
(2)ŹōÓŚĶ¬ĖŲŅģŠĪĢåµÄÓŠ_______________________;
(3)ŹōÓŚĶ¬·ÖŅģ¹¹ĢåµÄÓŠ______________________;
(4)ŹōÓŚĶ¬ĻµĪļµÄÓŠ__________________________£»
(5)ŹōÓŚĶ¬Ņ»ÖÖĪļÖŹµÄÓŠ______________________£»
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com