

| A. | 若四种元素均为主族元素,则d元素的原子半径最大 | |
| B. | 若b最外层电子占据三条轨道,则a的单质可用于冶炼金属 | |
| C. | 若a为非金属元素,则c的气态氢化物的水溶液可能呈碱性 | |
| D. | 若a最外层有两个未成对电子,则d的单质常温下不可能为气体 |
分析 A.电子层越多,原子半径越大,同周期原子序数大的原子半径小;
B.若b最外层电子占据三条轨道,b为第二周期元素,最外层电子排布为2s22p2,则b为C元素,结合位置可知a为Al;
C.若a为非金属元素,a为Si或P,则C为O或F;
D.若a最外层有两个未成对电子,a为第三周期元素,最外层电子排布为3s23p2或3s23p4,a为Si或S,结合位置可知,a为Si时d为S,a为S时d为Ar.
解答 解:A.电子层越多,原子半径越大,同周期原子序数大的原子半径小,则a元素的原子半径最大,故A错误;
B.若b最外层电子占据三条轨道,b为第二周期元素,最外层电子排布为2s22p2,则b为C元素,结合位置可知a为Al,金属铝可以通过铝热反应冶炼金属,故B正确;
C.若a为非金属元素,a为Si或P,则C为O或F,c的气态氢化物的水溶液为中性或酸性,故C错误;
D.若a最外层有两个未成对电子,a为第三周期元素,最外层电子排布为3s23p2或3s23p4,a为Si或S,结合位置可知,a为S时d为Ar,Ar的单质常温下为气体,故D错误;
故选B.
点评 本题考查位置、结构与性质的关系,为高频考点,把握原子结构、电子排布推断元素为解答的关键,侧重分析与应用能力的综合考查,注意元素周期律的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| u | 420 | 3100 | 4400 | 5900 |
| A. | T的氯化物最可能的化学式为TCl3 | |
| B. | 氦元素最有可能与Q元素位于同一族 | |
| C. | 在同周期表中,最可能处于同一族的是R和U | |
| D. | U元素最有可能为K,R元素最有可能为Li |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
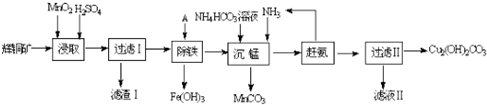
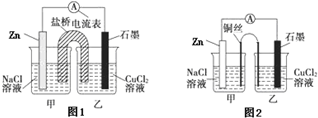
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$X与${\;}_{94}^{240}$Y互为同素异形体 | |
| B. | ${\;}_{94}^{238}$X与${\;}_{92}^{238}$Z互为同素异形体 | |
| C. | ${\;}_{94}^{240}$Y与${\;}_{92}^{238}$Z具有相同中子数 | |
| D. | ${\;}_{94}^{238}$X与${\;}_{92}^{238}$Z具有相同化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期放置的苯酚晶体变红 | B. | 硝酸银晶体光照后变黑 | ||
| C. | 氢氧化亚铁变灰绿再变红褐 | D. | 二氧化碳气体冷却后变淡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=4.3 的 CH3COOH与 CH3COONa 混合溶液中 tc(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4,溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCL)>KspCAg2CrCO4),则 AgCl的溶解度大于Ag2CrCO4 | |
| D. | 向冰醣酸加少就水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol/L CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol/LNaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol/L Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol/L( NH4)2CO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

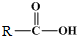 +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$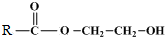
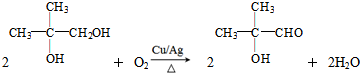 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com