
【题目】下列有关物质性质与用途具有对应关系的是( )
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.Al2O3是两性氧化物,可用作耐高温材料
C.SiO2硬度大,可用于制造光导纤维
D.NH3易溶于水,可用作制冷剂
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、[Al(OH)4]-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
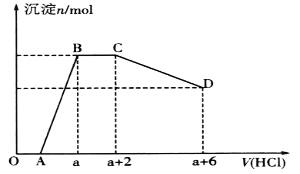
A. BC段是OH-与盐酸反应
B. 反应后最终溶液中的溶质只有NaC1
C. 原溶液中含有CO32-与[Al(OH)4]-的物质的量之比为3:4
D. 原溶液中一定含有的离子是Na+、OH-、SiO32-、SO42-、[A1(OH)4]-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:_________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2
H++HC2O4- Ka1=5.4×10-2
HC2O4-![]() H+C2O42- Ka2=5.4×10-5
H+C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH______7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如右图1,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600 ℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列装置属于原电池的是________。
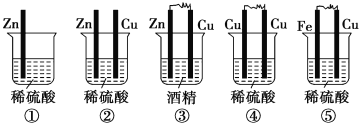
(2)在选出的原电池中,________是负极,发生________反应,________是正极,该极的现象是______________________________。
(3)此原电池反应的化学方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E、M、N六种短周期主族元素,它们的核电荷数依次增大。A可与D、E形成10电子分子,其中B的最外层电子数等于次外层电子数,C原子最外层电子数是次外层电子数的2倍,M的L层电子数为K层和M层电子数之和,D和M同主族。回答下列问题:
(1)元素B的符号和名称分别是____,______;在周期表中的位置是_________________。
(2)元素C的原子结构示意图为______________________________。
(3)元素C与M可形成CM2,C与N可形成CN4,这两种化合物均可做溶剂,其电子式分别为:________________和____________________。
(4)元素A与D、E形成10电子分子的结构式分别为:_______________和 _________________。
(5)元素D和M相比,非金属性较强的是_____________(用元素符号表示)。
(6)元素D、M的氢化物的沸点高低顺序为:______________________(用化学式表示)。
(7)在一定条件下,A、D的单质和M的最高价氧化物对应水化物的溶液可构成原电池,该电池在放电过程中,电解质溶液的酸性将_____________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是 ( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.碱性溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国最新战机歼一31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应为TiCl4+2Mg=Ti+2MgCl2。下列有关该反应的说法正确的是( )
A.Mg被氧化B.TiCl4是还原剂
C.Ti是氧化产物D.24g Mg参加反应转移1mol e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com