
| A. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| B. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA | |
| C. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA |
分析 A.标况下三氧化硫不是气体;
B.过氧化钠与二氧化碳反应,过氧化钠既做氧化剂又做还原剂,消耗1mol过氧化钠转移1mol电子;
C.只有浓硫酸与铜反应,稀硫酸与铜不反应;
D.粗铜中含有杂质铁、锌等较活泼金属,电解过程中铁、锌优先放电.
解答 解:A.气体摩尔体积适用对象为气体,标况下三氧化硫不是气体,不能使用气体摩尔体积,故A错误;
B.78g Na2O2的物质的量为1mol,与过量CO2反应,CO2转移的电子数为NA,故B错误;
C.随着反应进行,浓硫酸浓度降低,变为稀硫酸不再发生反应,所以含0.2mol H2SO4的浓硫酸与足量铜充分反应,消耗的硫酸小于0.2mol,生成的二氧化硫的数目小于0.1NA,故C正确;
D.电解精炼铜时,若阳极质量减少32g,由于阳极有铁杂质存在,铁的摩尔质量小于铜的,所以阳极减少32g,转移的电子的物质的量大于1mol,则阴极得到的电子数大于NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,注意只有浓硫酸与铜才能发生反应,题目难度不大.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:解答题
 如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.| 族 周期 | ⅠA | 0 | ||||||||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
| 2 | X | Y | G | |||||||||||
| 3 | Z | … | H | W | E | |||||||||
| 4 | … | Q | ||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
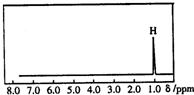 核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )
核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )| A. | CH3C(CH3)3 | B. | CH3CH2CH3 | C. | CH2=CHCH3 | D. | (CH3)2CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1pH=2的HF溶液加水稀释,$\frac{c({H}^{+})}{c(HF)}$增大 | |
| B. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的NH3•H2O溶液和NH4Cl溶液等体积混合:c(NH4+)+c(NH3•H2O)=2c(Cl-) | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | 25℃时,由水电离出来的c(H+)和c(OH-)的乘积为1×10-2 4的某溶液中: Fe2+、NO3-、AlO2-、Na+ | 不能共存 | 发生反应: 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O |
| B | 澄清石灰水中: Ca2+、K+、CH3COO-、HCO3- | 不能共存 | 发生反应: Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C | 常温常压下,空气中: NH3、NO、H2、CO2 | 可以共存 | 不能发生反应 |
| D | 银氨溶液中: K+、Na+、NO3-、Cl- | 可以共存 | 不能发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X | |
| B. | 化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 | |
| C. | 用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时后,在阴极区会出现白色沉淀 | |
| D. | X、Z两元素能形成原子个数比(X:Z)为3:1和2:1的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与乙酸在浓硫酸加热条件下反应 | |
| B. | 乙烯通入溴的四氯化碳溶液 | |
| C. | 苯与浓硝酸、浓硫酸的混合物共热 | |
| D. | 乙醇在铜粉存在下与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有自发进行的化学反应都是放热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com