
【题目】下列离子方程式书写正确的是( )
A.碘化亚铁中通入过量氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
C.1molL﹣1的NaAlO2溶液和2.5molL﹣1的HCl溶液等体积互相均匀混合:2AlO2﹣+5H+=Al3++Al(OH)3↓+H2O
D.用铜作电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
【答案】C
【解析】
A. 碘化亚铁中通入过量氯气,反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,故A错误;
B. 明矾溶液的溶质为KAl(SO4)2,向其中滴入Ba(OH)2溶液使SO42-恰好完全沉淀时,铝元素以偏铝酸根离子形式存在,其离子方程式为:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O,故B错误;
C. 1molL-1的NaAlO2溶液和2.5molL﹣1的HCl溶液等体积互相均匀混合,两者的物质的量之比为:2:5,反应的离子方程式为:2AlO2﹣+5H+=Al3++Al(OH)3↓+H2O,故C正确;
D. 用铜作电极电解CuSO4溶液与电解精炼铜的原理相同,阳极铜失电子生成Cu2+,阴极Cu2+得电子生成铜单质,故D错误;
答案选C。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
② 2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是( )
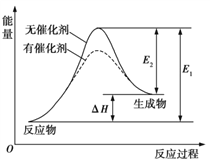
A. E1表示2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g)的活化能
2CO(g)+4H2(g)的活化能
B. E2表示CH4(g)+H2O(g)![]() CO(g)+3H2(g)的活化能
CO(g)+3H2(g)的活化能
C. 该图示为反应②的反应过程与能量变化示意图
D. 一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A.该反应的正反应是吸热反应
B.恒温时减小容器体积增大压强,正反应速率增大
C.830 ℃时,反应达到平衡,一定是c(CO) = c(CO2)
D.400 ℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电化学原理可同时将SO2、CO2变废为宝,装置如图所示(电极均为惰性电极)。下列说法不正确的是
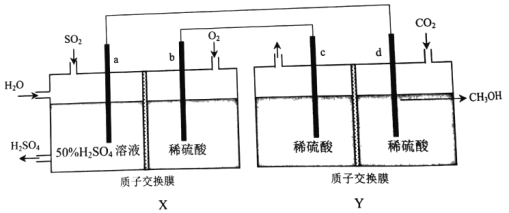
A. a为负极,发生氧化反应
B. 装置工作时,电子从c极流入b极
C. 若b极消耗16gO2,则Y中左侧溶液质量减轻16g
D. d电极反应式为CO2+6H++6e-=CH3OH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某石油化工产品X的转化关系如图,下列判断不正确的是( )

A. X可以发生加聚反应B. Y能与钠反应产生氢气
C. Z与CH3OCH3互为同分异构体D. W的结构简式为CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 水解的说法错误的是( )
水解的说法错误的是( )
A.在稀溶液中,水解达到平衡时,无论加![]() 饱和溶液还是加水稀释,平衡均向右移动
饱和溶液还是加水稀释,平衡均向右移动
B.浓度为![]() 和
和![]() 的两种
的两种![]() 溶液,其他条件相同时,
溶液,其他条件相同时,![]() 的水解程度前者小于后者
的水解程度前者小于后者
C.其他条件相同时,同浓度的![]() 溶液在50 ℃和20 ℃时发生水解,50 ℃时
溶液在50 ℃和20 ℃时发生水解,50 ℃时![]() 的水解程度比20 ℃时的小
的水解程度比20 ℃时的小
D.为抑制![]() 的水解,更好地保存
的水解,更好地保存![]() 溶液,应加少量盐酸
溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知![]() ]。下列叙述不正确的是( )
]。下列叙述不正确的是( )

A.NaHA溶液中,HA-的水解能力小于HA-的电离能力
B.lg[K2(H2A)]=-4.2
C.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
D.0.1 mol·L1 NaHA溶液中:c(Na+)+c(A2)+c(H2A)+c(HA)=0.2 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硼、氮、磷、铜、锌的化合物有许多重要用途。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为____;基态Cu+的核外电子排布式为___。
(2)![]() 的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因_______________。
的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因_______________。
(3)亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为____。
(4)Zn2+可与CN-、二苯硫腙(![]() )等形成稳定配合物。
)等形成稳定配合物。
①CN- 的结构式为_____。
②每个二苯硫腙分子中,采取sp2杂化的原子有__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。

下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com