
用0.05mol?L-1H2SO4溶液测定未知浓度的NaOH溶液,得到的滴定曲线如下图所示。
(1)用甲基橙做指示剂,滴定终点时颜色的变化是___________________。
(2)NaOH溶液的物质的量浓度是_________。
(3)NaOH溶液的体积是________。
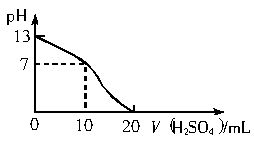
(1)由黄色变成橙色,并不立即退色
(2)0?郾1mol?L-1
(3)10mL


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
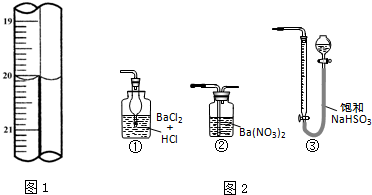
科目:高中化学 来源: 题型:阅读理解
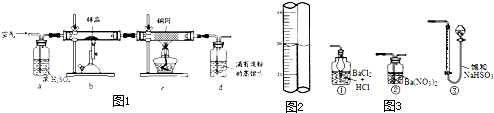
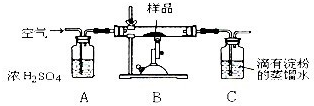
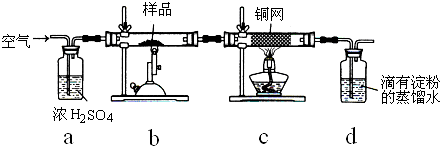
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:| 装置 | A (试管+粉末) |
B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 10 |
查看答案和解析>>
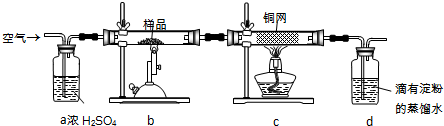
科目:高中化学 来源: 题型:阅读理解
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com