
 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)分析 (1)N2O4?2NO2的正反应气体物质的量增大,为熵增反应;
(2)由图可知,20~40s内△c(N2O4)=(0.07-0.05)mol/L=0.02mol/L,则△c(NO2)=2△c(N2O4)=0.04mol/L,再根据v=$\frac{△c}{△t}$计算v(NO2);
(3)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
由图可知,平衡时c(N2O4)=0.04mol/L,平衡时△c(N2O4)=(0.1-0.04)mol/L=0.06mol/L,故平衡时△c(NO2)=2△c(N2O4)=0.12mol/L,代入平衡常数表达式计算;
(4)根据平衡常数相对大小判断降低温度平衡移动方向,降低温度平衡向放热反应方向移动.
解答 解:(1)N2O4?2NO2的正反应气体物质的量增大,为熵增反应,则:△S>0,故答案为:>;
(2)由图可知,20~40s内△c(N2O4)=(0.07-0.05)mol/L=0.02mol/L,则△c(NO2)=2△c(N2O4)=0.04mol/L,则v(NO2)=$\frac{0.04mol/L}{40s-20s}$=0.002mol•L-1•s-1,故答案为:0.002;
(3)N2O4?2NO2的化学平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,由图可知,平衡时c(N2O4)=0.04mol/L,平衡时△c(N2O4)=(0.1-0.04)mol/L=0.06mol/L,故平衡时△c(NO2)=2△c(N2O4)=0.12mol/L,平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$=$\frac{0.1{2}^{2}}{0.04}$=0.36,故答案为:$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;0.36;
(4)已知323k时,该反应N2O4?2NO2的化学平衡常数K=0.022,小于373k时平衡常数K=0.36,说明降低温度平衡逆向移动,降低温度平衡向放热反应方向移动,则正反应为吸热反应,故△H>0,故答案为:>.
点评 本题考查化学平衡有关计算,涉及反应速率计算、平衡常数计算与影响因素,注意平衡常数只受温度影响,平衡常数及单位与方程式中化学计量数有关.


科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 阿伏加德罗常数是12 kg 12C中含有的碳原子数 | |
| C. | 1 molH2O分子中含有10 mol电子 | |
| D. | 一个NO分子的质量是a g,一个NO2分子的质量是b g,则氧原子的摩尔质量是(b-a)g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用以下反应制取氮气:NaNO2+NH4Cl$\underset{\stackrel{65℃}{=}}{△}$NaCl+N2↑+2H20,已知氮化镁易与水反应,Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓在设计装置时必须考虑这一点:
用以下反应制取氮气:NaNO2+NH4Cl$\underset{\stackrel{65℃}{=}}{△}$NaCl+N2↑+2H20,已知氮化镁易与水反应,Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓在设计装置时必须考虑这一点:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如图所示的反应为放热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 化学反应具有方向性 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| B. | 实验室可用排饱和食盐水的方法收集氯气 | |
| C. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| D. | 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
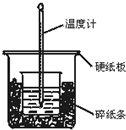 通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com