
元素的性质随着元素原子序数的递增而呈周期性变化的原因是
A.元素原子的核外电子排布呈周期性变化
B.元素的原子半径呈周期性变化
C.元素的化合价呈周期性变化
D.元素的金属性、非金属性呈周期性变化
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:2013-2014湖南省益阳市高一上学期期末考试化学(理)试卷(解析版) 题型:选择题
已知在热的碱性溶液中,NaClO能发生如下反应:3NaClO=2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,则其最终产物是
A.NaCl、NaClO B.NaCl、NaClO3 C.NaClO、NaClO3 D.NaClO2、NaClO4
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省岳阳市高三教学质量检测二理综化学试卷(解析版) 题型:选择题
化学与环境、科学、技术密切相关。下列有关说法中正确的是
A.煤经过气化和液化等物理变化可以转化为清洁燃料
B.在海轮外壳上镶入锡块,可减缓船体的腐蚀速率
C.光化学烟雾的形成与汽车尾气中的氮氧化物有关
D.“鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
下列有关化学反应速率的说法中,正确的是
A.往容积一定的容器中再通入O2,可以加快反应2SO2+O2 2SO3的反应速率
2SO3的反应速率
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.对于C(s)+H2O(g)  CO(g)+H2(g)的反应,加入固体炭,反应速率加快
CO(g)+H2(g)的反应,加入固体炭,反应速率加快
D.100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
下列反应中,不属于取代反应的是
A.在催化剂存在条件下苯与溴反应制溴苯
B.苯与浓硝酸、浓硫酸混合共热制取硝基苯
C.乙烯与溴生成1,2?二溴乙烷
D.在光照条件下甲烷和氯气反应制氯仿
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高二化学试卷(解析版) 题型:填空题
(10分)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定。该反应的化学方程式如下:
C6H8O6+I2===C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下:
取10 mL 6 mol·L-1CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中,加入1 mL指示剂,立即用浓度为0.05000 mol·L-1的I2溶液进行滴定到终点,消耗21.00 mL I2溶液。
(1)实验中的指示剂是_____________。
(2)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用。煮沸的目的是________________;冷却的目的是__________________。
(3)计算样品中维生素C的质量分数(要求列式,且式中各物理量带单位)。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高二化学试卷(解析版) 题型:选择题
卤代烃的取代反应,实质是带负电荷的原子团取代了卤代烃中的卤原子,如CH3Br+OH-(或NaOH)―→CH3OH+Br-(或NaBr),下列反应的化学方程式中,不正确的是
A.CH3CH2Br+NaHS―→CH3CH2SH+NaBr
B.CH3I+CH3ONa―→CH3OCH3+NaI
C.CH3CH2Cl+CH3ONa―→CH3CH2ONa+CH3Cl
D.CH3CH2Cl+CH3CH2ONa―→(CH3CH2)2O+NaCl
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:填空题
(11分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,最高价氧化物的水化物的碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为 、 ,原子半径最大的金属元素的名称是 ,离子半径最小的离子结构示意图是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:填空题
(14分)(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:

则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g) N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
则平衡时氨气的转化率为___________。
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如下图所示:
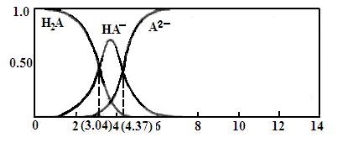
已知:103.04=1.1×103,104.37=2.3×104 25℃,Ka1(H2CO3)= 4.4×10-7 Ka2(H2CO3) = 4.7×10-11
①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,c(A2-)/c(HA-)的值 (填“增大”、“减小”或“不变”,下同),c(H+)/c(OH-) 的值 。
②若向0.1NaHAmol·L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+) c(A2-) (填“大于”、“小于”或“等于”)。
③计算HA-二级电离平衡常数Ka2= 。
④将过量H2A加入Na2CO3溶液中反应的离子方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com