
分析 ①铝合金中含有合金元素铁、铜、硅,铝、铁能和稀盐酸反应,Cu、Si与稀盐酸不反应,且盐酸过量,过滤除去铜硅,过滤用到的仪器有:漏斗、烧杯、玻璃棒;
②向上述滤液中加入过量的NaOH溶液后发生反应过滤,得到氢氧化亚铁沉淀和偏铝酸钠溶液,再向所得滤液中通入足量的CO2气体发生反应为二氧化碳和过量的氢氧化钠溶液反应生成碳酸氢钠,和偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸氢钠,将所得沉淀氢氧化铝过滤出来并用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称重,其质量为n g,为Al2O3,依据铝元素守恒计算含量.
解答 解:铝合金中含有合金元素铁、铜、硅,铝、铁能和稀盐酸反应,Cu、Si与稀盐酸不反应,且盐酸过量,过滤除去铜和硅,得到氯化亚铁和氯化铝的混合溶液,过滤用到的仪器有:漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
②向上述滤液中加入过量的NaOH溶液后发生反应过滤,得到氢氧化亚铁沉淀和偏铝酸钠溶液,再向所得滤液中通入足量的CO2气体发生反应为二氧化碳和过量的氢氧化钠溶液反应生成碳酸氢钠,和偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:OH-+CO2=HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,将所得沉淀氢氧化铝过滤出来并用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称重,其质量为n g,为Al2O3,物质的量n=$\frac{ng}{102g/mol}$=$\frac{n}{102}$mol,依据铝元素守恒计算,则该合金样品中金属铝的含量=$\frac{\frac{n}{102}mol×2×27g/mol}{mg}$×100%=$\frac{9n}{17m}$×100%,
故答案为:OH-+CO2=HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,$\frac{9n}{17m}$×100%.
点评 本题考查物质含量测定、实验基本操作、元素化合物性质等,难度不大,关键是理解实验原理,题目容易忽略二氧化碳与碱的反应.


科目:高中化学 来源: 题型:选择题
| A. | 12.0g熔融的NaHSO4中含有的阳离子数为0.2NA | |
| B. | Na2O2与足量CO2反应生成2.24LO2,转移电子数为0.2NA | |
| C. | 4.6gNO2和N2O4混合物中含有的原子总数为0.3NA | |
| D. | 用惰性电极电解1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4g金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量一定相等 | |
| B. | 任何条件下,等物质的量的二氧化硫和一氧化碳所含的分子数一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和  D、35Cl和37Cl
D、35Cl和37Cl
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.8g | B. | 22.4g | C. | 21g | D. | 19.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
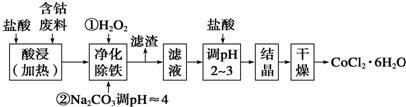
| 物质 | 溶度积Ksp | 沉淀完全时的pH |
| Co(OH)2 | 5.9×10-15 | 9.4 |
| Fe(OH)2 | 1.6×10-14 | 9.6 |
| Fe(OH)3 | 1.1×10-36 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:Na+、Fe3+、SO42-、Cl- | |
| B. | 饱和氯水:K+、Na+、Cl-、HSO3- | |
| C. | pH=13溶液:Na+、K+、SiO32-、Cl- | |
| D. | 1.0mol/L KNO3溶液:H+、Fe2+、Cl-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com