
| A. | 将SO2通入品红溶液中,溶液的红色褪去 | |
| B. | 将5滴氯化铁饱和溶液滴入25mL煮沸的蒸馏水中继续加热,液体变红褐色 | |
| C. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 | |
| D. | 将葡萄糖溶液加入新制Cu(OH)2悬浊液加热至沸腾,出现砖红色沉淀 |
分析 A.SO2通入品红溶液中发生化合反应使溶液的红色褪去;
B.铁离子水解生成胶体;
C.向Fe2(SO4)3溶液中滴加NaOH溶液生成红褐色氢氧化铁;
D.葡萄糖含-CHO,具有还原性.
解答 解:A.SO2通入品红溶液中发生化合反应使溶液的红色褪去,没有发生化合价变化,与氧化还原反应无关,故A不选;
B.铁离子水解生成胶体,变成红褐色胶体,与氧化还原反应无关,故B不选;
C.向Fe2(SO4)3溶液中滴加NaOH溶液发生复分解反应生成红褐色氢氧化铁沉淀,与氧化还原反应无关,故C不选;
D.葡萄糖含-CHO,具有还原性,则加入新制Cu(OH)2悬浊液中并加热至沸腾,发生氧化还原反应生成砖红色的氧化亚铜沉淀,与氧化还原反应有关,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意现象与反应的判断,题目难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| B. | 1mol Na218O2中所含的中子数为42NA | |
| C. | 28g铁粉与足量稀硝酸反应,转移的电子数为NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅熔点高,可用作光导纤维 | |
| B. | 过氧化钠可与二氧化碳反应生成氧气,可用作呼吸供氧剂 | |
| C. | 明矾易溶于水,可用作净水剂 | |
| D. | 二氧化硫有氧化性,可用于漂白纸张 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物 | |
| B. | Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存 | |
| C. | 在呼吸面具中,Na2O2能做供氧剂,而Na2O不能 | |
| D. | 将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量守恒原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
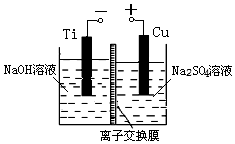 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
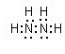 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1g37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78g | |
| C. | 7.8g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24L乙烷含有的共价键数为1.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| N2 | H2 | NH3 | NH3 | ||
| ① | 500 | 1 | 3 | 0 | 0.5 |
| ② | 500 | 0.6 | 1.8 | 0 | |
| ③ | 550 | 0 | 0 | 2 | a |
| A. | 容器①、②中反应的平衡常数不相等 | |
| B. | 达平衡时,容器②中H2的转化率大于25% | |
| C. | a<0.5 | |
| D. | 起始时向容器①中充入1 mol N2、2 mol H2、0.5 mol NH3,则反应将向逆反应方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com