
ЁОЬтФПЁПЪвЮТЯТЃЌШЁ10 mL 0.1 molL1ФГЖўдЊЫсH2AЃЌЕЮМг0.1 molL1 NaOHШмвКЁЃвбжЊЃКH2AЃНH+ + HAЃЃЌHAЃ![]() H+ + A2ЃЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
H+ + A2ЃЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.A2ЃПЩОЙ§СНВНЫЎНтЕУЕНH2A
B.ЕБгУШЅNaOHШмвКЬхЛ§10 mLЪБЃЌШмвКжаРызгХЈЖШДѓаЁЫГађЮЊЃКc(Na+)>c(HAЃ)>c(H+)>c(A2Ѓ)>c(OHЃ)
C.ЕБЕЮМгжСжаадЪБЃЌШмвКжагаc(Na+)ЃНc(HAЃ) + c(A2Ѓ)
D.ЕБгУШЅNaOHШмвКЬхЛ§20 mLЪБЃЌДЫЪБШмвКжагаc(Na+)ЃНc(HAЃ) + c(A2Ѓ)
ЁОД№АИЁПB
ЁОНтЮіЁП
A. H2AЮЊЧПЕчНтжЪЃЌЭъШЋЕчРыЩњГЩH+ ЁЂHAЃЃЌA2ЃПЩОЙ§ЫЎНтжЛФмЕУЕНHA-ЃЌAДэЮѓЃЛ
B. ЕБгУШЅNaOHШмвКЬхЛ§10 mLЪБЃЌШмвКжаЕФШмжЪЮЊNaHAЃЌРызгХЈЖШДѓаЁЫГађЮЊЃКc(Na+)>c(HAЃ)>c(H+)>c(A2Ѓ)>c(OHЃ)ЃЌBе§ШЗЃЛ
C. ЕБЕЮМгжСжаадЪБЃЌИљОнШмвКГЪЕчжаадЃЌc(Na+) +c(H+)=c(HAЃ)+2c(A2Ѓ)+c(OHЃ)МАc(H+)= c(OHЃ)ЃЌШмвКжагаc(Na+)ЃНc(HAЃ) + 2c(A2Ѓ)ЃЌCДэЮѓЃЛ
D. ЕБгУШЅNaOHШмвКЬхЛ§20 mLЪБЃЌШмжЪЮЊNa2AЃЌИљОнЮяСЯЪиКуДЫЪБШмвКжагаc(Na+)ЃН2c(HAЃ) + 2c(A2Ѓ)ЃЌDДэЮѓЃЛ
Д№АИЮЊBЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДМгыЧтТБЫсЗДгІЪЧжЦБИТБДњЬўЕФживЊЗНЗЈЁЃЪЕбщЪвжЦБИфхввЭщКЭ1-фхЖЁЭщЕФЗДгІШчЯТЃК
NaBr+H2SO4=HBr+NaHSO4 Ђй
R-OH+HBr![]() R-Br+H2O Ђк
R-Br+H2O Ђк
ПЩФмДцдкЕФИБЗДгІгаЃКДМдкХЈСђЫсЕФДцдкЯТЭбЫЎЩњГЩЯЉКЭУбЃЌBr-БЛХЈСђЫсбѕЛЏЮЊBr2ЕШЁЃгаЙиЪ§ОнСаБэШчЯТЃК
ввДМ | фхввЭщ | е§ЖЁДМ | 1-фхЖЁЭщ | |
УмЖШ/gЁЄcm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
ЗаЕу/Ёц | 78.5 | 38.4 | 117.2 | 101.6 |
ЧыЛиД№ЃК
ЃЈ1ЃЉЕУЕНЕФфхввЭщжаКЌгаЩйСПввДМЃЌЮЊСЫжЦЕУДПОЛЕФфхввЭщЃЌПЩгУеєСѓЫЎЯДЕгЃЌЗжвККѓЃЌдйМгШыЮоЫЎCaCl2ЃЌШЛКѓНјааЕФЪЕбщВйзїЪЧ___ЃЈЬюзжФИЃЉЁЃ
aЃЎЗжвК bЃЎеєСѓ cЃЎнЭШЁ dЃЎЙ§ТЫ
ЃЈ2ЃЉфхввЭщЕФЫЎШмад___ввДМЃЈЬюЁАДѓгкЁБЁЂЁАЕШгкЁБЛђЁАаЁгкЁБЃЉЃЌЦфдвђЪЧ___ЁЃ
ЃЈ3ЃЉНЋ1-фхЖЁЭщДжВњЦЗжУгкЗжвКТЉЖЗжаМгЫЎЃЌеёЕДКѓОВжУЃЌВњЮядк___ЃЈЬюЁАЩЯВуЁБЁЂЁАЯТВуЁБЛђЁАВЛЗжВуЁБЃЉЁЃ
ЃЈ4ЃЉжЦБИВйзїжаЃЌМгШыЕФХЈСђЫсБиаыНјааЯЁЪЭЃЌЦфФПЕФЪЧ___ЃЈЬюзжФИЃЉЁЃ
aЃЎМѕЩйИБВњЮяЯЉКЭУбЕФЩњГЩ bЃЎМѕЩйBr2ЕФЩњГЩ
cЃЎМѕЩйHBrЕФЛгЗЂ dЃЎЫЎЪЧЗДгІЕФДпЛЏМС
ЃЈ5ЃЉЮЊСЫМьбщфхввЭщжаКЌгафхдЊЫиЃЌЭЈГЃВЩгУЕФЗНЗЈЪЧЃКШЁЩйСПфхввЭщЃЌШЛКѓНјааЯТСаВйзїЃКЂйМгШШ ЂкМгШыAgNO3ШмвК ЂлМгШыЯЁHNO3ЫсЛЏ ЂмМгШыNaOHШмвКЁЃЯТСаВйзїЫГађКЯРэЕФЪЧ___ЃЈЬюзжФИЃЉЁЃ
aЃЎЂйЂкЂлЂм bЃЎЂкЂлЂйЂм cЃЎЂмЂйЂлЂк dЃЎ ЂйЂмЂкЂл
ЃЈ6ЃЉдкжЦБИфхввЭщЪБЃЌВЩгУБпЗДгІБпеєГіВњЮяЕФЗНЗЈЃЌЦфгаРћгк___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПе§ЖЁШЉЪЧвЛжжЛЏЙЄдСЯЁЃФГЪЕбщаЁзщРћгУШчЯТзАжУКЯГЩе§ЖЁШЉЁЃЗЂЩњЕФЗДгІШчЯТЃК
CH3CH2CH2CH2OH![]() CH3CH2CH2CHOЃЌЗДгІЮяКЭВњЮяЕФЯрЙиЪ§ОнСаБэШчЯТЃК
CH3CH2CH2CHOЃЌЗДгІЮяКЭВњЮяЕФЯрЙиЪ§ОнСаБэШчЯТЃК
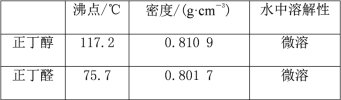
ЪЕбщВНжшШчЯТЃК
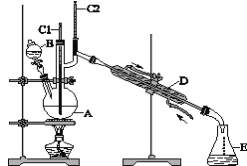
НЋ6.0g Na2Cr2O7ЗХШы100mLЩеБжаЃЌМг30mLЫЎШмНтЃЌгы5mLХЈСђЫсаЮГЩЛьКЯШмвКЃЌНЋЫљЕУШмвКаЁаФзЊвЦжСBжаЁЃдкAжаМгШы4.0gе§ЖЁДМКЭМИСЃЗаЪЏЃЌМгШШЁЃЕБгаеєЦјГіЯжЪБЃЌПЊЪМЕЮМгBжаШмвКЁЃЕЮМгЙ§ГЬжаБЃГжЗДгІЮТЖШЮЊ90ЁЋ95ЁцЃЌдкEжаЪеМЏ90ЁцвдЯТЕФСѓЗжЁЃНЋСѓГіЮяЕЙШыЗжвКТЉЖЗжаЃЌЗжШЅЫЎВуЃЌгаЛњВуИЩдяКѓеєСѓЃЌЪеМЏ75ЁЋ77ЁцСѓЗжЃЌВњСП2.0gЁЃ
ЃЈ1ЃЉЪЕбщжаЃЌNa2Cr2O7ШмвККЭХЈСђЫсЬэМгЕФЫГађЮЊ__________ЁЃ
ЃЈ2ЃЉМгШыЗаЪЏЕФзїгУЪЧ_______________ЁЃ ШєМгШШКѓЗЂЯжЮДМгЗаЪЏЃЌгІВЩШЁЕФе§ШЗЗНЗЈЪЧ_________ЁЃ
ЃЈ3ЃЉЩЯЪізАжУЭМжаЃЌDвЧЦїЕФУћГЦЪЧ______________ЃЌEвЧЦїЕФУћГЦЪЧ_______ЁЃ
ЃЈ4ЃЉЗжвКТЉЖЗЪЙгУЧАБиаыНјааЕФВйзїЪЧ_________ЁЃ
ЃЈ5ЃЉНЋе§ЖЁШЉДжВњЦЗжУгкЗжвКТЉЖЗжаЗжЫЎЪБЃЌе§ЖЁШЉдк_______ВуЃЈЬюЁАЩЯЁБЛђЁАЯТЁБЃЉЁЃ
ЃЈ6ЃЉБОЪЕбщжаЃЌе§ЖЁШЉЕФВњТЪЮЊ_______%ЃЈНсЙћБЃСєСНЮЛаЁЪ§ЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЂЩњЮяШМСЯЕчГиЪЧжИдкЮЂЩњЮяЕФзїгУЯТНЋЛЏбЇФмзЊЛЏЮЊЕчФмЕФзАжУЁЃФГЮЂЩњЮяШМСЯЕчГиЕФЙЄзїдРэШчЭМЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. HS-дкСђбѕЛЏОњзїгУЯТзЊЛЏЮЊSO42-ЕФЗДгІЮЊ:HS-+4H2O-8e-== SO42-+9H+
B. ЕчзгДгbСїГіЃЌОЭтЕчТЗСїЯђa
C. ШчЙћНЋЗДгІЮяжБНгШМЩе,ФмСПЕФРћгУТЪВЛЛсБфЛЏ
D. ШєИУЕчГиЕчТЗжага0.4molЕчзгЗЂЩњзЊвЦЃЌдђга0.45molH+ЭЈЙ§жЪзгНЛЛЛФЄ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНёгавЛЛьКЯЮяЕФЫЎШмвКЃЌжЛПЩФмКЌгавдЯТРызгжаЕФШєИЩжжЃК![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЯжШЁСНЗн200mLШмвКНјааШчЯТЪЕбщЃКЂйЕквЛЗнМгзуСПNaOHШмвКЃЌМгШШЃЌЪеМЏЕНЦјЬх
ЯжШЁСНЗн200mLШмвКНјааШчЯТЪЕбщЃКЂйЕквЛЗнМгзуСПNaOHШмвКЃЌМгШШЃЌЪеМЏЕНЦјЬх![]() ЃЛЂкЕкЖўЗнМгзуСП
ЃЛЂкЕкЖўЗнМгзуСП![]() ШмвККѓЃЌЕУИЩдяГСЕэ
ШмвККѓЃЌЕУИЩдяГСЕэ![]() ЃЌОзуСПбЮЫсЯДЕгЁЂИЩдяКѓЃЌГСЕэжЪСПЮЊ
ЃЌОзуСПбЮЫсЯДЕгЁЂИЩдяКѓЃЌГСЕэжЪСПЮЊ![]() ИљОнЩЯЪіЪЕбщЃЌвдЯТЭЦВте§ШЗЕФЪЧ
ИљОнЩЯЪіЪЕбщЃЌвдЯТЭЦВте§ШЗЕФЪЧ![]()
A.вЛЖЈВЛДцдк![]() ЃЌ
ЃЌ![]() ПЩФмДцдк
ПЩФмДцдк
B.![]() вЛЖЈДцдкЃЌ
вЛЖЈДцдкЃЌ![]() ПЩФмДцдк
ПЩФмДцдк
C.![]() вЛЖЈДцдк
вЛЖЈДцдк
D.вЛЖЈВЛДцдк![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдгкЗХШШЗДгІH2 + Cl2![]() 2HClЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃК
2HClЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃК
A.ВњЮяЫљОпгаЕФзмФмСПИпгкЗДгІЮяЫљОпгаЕФзмФмСП
B.ЗДгІЮяЫљОпгаЕФзмФмСПИпгкВњЮяЫљОпгаЕФзмФмСП
C.ЖЯПЊ1mol HЁЊHМќКЭ1mol ClЁЊClМќЫљЮќЪеЕФзмФмСПаЁгкаЮГЩ1mol HЁЊClМќЫљЗХГіЕФФмСП
D.ИУЗДгІжаЃЌЛЏбЇФмжЛгазЊБфЮЊШШФм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгЩКЌЕтЗЯЫЎжЦШЁЕтЫсМиЕФвЛжжЙЄвеШчЯТЃК

ЃЈ1ЃЉH2O2ЕФНсЙЙЪНЮЊ___ЁЃЁАжЦI2ЁБЙ§ГЬжаМгШыЕФСђЫсВЛФмЙ§ЖрЕФдвђЪЧ_____ЁЃ
ЃЈ2ЃЉжЦCuIЃЈsЃЉВНжшЗДгІЕФРызгЗНГЬЪНЮЊ_________ЁЃ
ЃЈ3ЃЉЙЄвежаЮхжжЮяжЪЕФжЦБИЗДгІжаЃЌВЛЩцМАбѕЛЏЛЙдЗДгІЕФВНжшЪЧЁАжЦ___ЁБЁЃ
ЃЈ4ЃЉЁАжЦKIЃЈaqЃЉЁБЪБЃЌИУЮТЖШЯТЫЎЕФРызгЛ§ЮЊKwЃН1.0ЁС10Ѓ13ЃЌKsp[FeЃЈOHЃЉ2]ЃН9.0ЁС10Ѓ15ЁЃЮЊБмУт0.9 molЁЄLЃ1 FeI2ШмвКжаFe2+ЫЎНтЩњГЩНКзДЮяЮќИНI-ЃЌЦ№ЪММгШыK2CO3БиаыБЃГжШмвКЕФpHВЛДѓгк________ЁЃ
ЃЈ5ЃЉЁАжЦKIO3ШмвКЁБЗДгІЕФРызгЗНГЬЪНЮЊ______ЁЃ
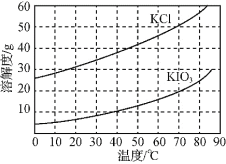
ЃЈ6ЃЉKClЁЂKIO3ЕФШмНтЖШЧњЯпШчЭМЫљЪОЁЃСїГЬжагЩЁАKIO3ЃЈaqЃЉЁБЕУЕНKIO3ОЇЬхЕФВйзїВНжшЮЊ____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉвбжЊЃКЂй C(s) + O2(g)ЃНCO2(g) HЃНЃ393.5 kJmolЃ1
Ђк2CO(g) + O2(g)ЃН2CO2(g) HЃНЃ566 kJmolЃ1
ЂлTiO2(s) + 2Cl2(g)ЃНTiCl4(s) + O2(g) HЃН+141 kJmolЃ1
дђTiO2(s) + 2Cl2(g) + 2C(s)ЃНTiCl4(s) + 2CO(g)ЕФHЃН_________________ЁЃ
ЃЈ2ЃЉТШЛЏвјдкЫЎжаДцдкГСЕэШмНтЦНКтAgCl(s)![]() Ag+(aq) + ClЃ(aq)ЁЃ25ЁцЪБЃЌТШЛЏвјЕФKsp=1.8ЁС10-10ЃЌЯжНЋзуСПЕФТШЛЏвјМгШыЕН0.1 molLЃ1ТШЛЏТСШмвКжаЃЌвјРызгХЈЖШзюДѓПЩДяЕН_____________molLЃ1ЁЃ
Ag+(aq) + ClЃ(aq)ЁЃ25ЁцЪБЃЌТШЛЏвјЕФKsp=1.8ЁС10-10ЃЌЯжНЋзуСПЕФТШЛЏвјМгШыЕН0.1 molLЃ1ТШЛЏТСШмвКжаЃЌвјРызгХЈЖШзюДѓПЩДяЕН_____________molLЃ1ЁЃ
ЃЈ3ЃЉ20 ЁцЪБЃЌ0.1 molLЃ1 NH4Al(SO4)2ШмвКЕФpHЃН3ЃЌдђЃК2c(SO42Ѓ)Ѓc(NH4+)Ѓ3c(Al3+)Ёж______________molLЃ1ЃЈЬюЪ§жЕЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ H2(g) ЃЋ Cl2 (g)===2HCl(g) ІЄ H ЃНЃ 184.6 kJ ЁЄ mol-1дђЗДгІЃКHCl(g)===1/2H2(g)ЃЋ1/2Cl2(g)ЕФІЄH ЮЊ( )
A.ЃЋ184.6 kJЁЄmol-1B.Ѓ92.3 kJЁЄmol-1
C.Ѓ369.2 kJЁЄmol-1D.ЃЋ92.3 kJЁЄmol-1
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com