
【题目】“乃焰硝、硫磺、杉木炭所合,以为烽燧铳机诸药者”是对我国古代四大发明之一的火药的描述。其中,“焰硝”是
A.KClO3B.Na2SO4C.KNO3D.Na2O2
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、D、X、Y、Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D﹣和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
(1)Z2+的价层电子排布式为 .
(2)D、X、Y三种元素中第一电离能从大到小的顺序是 . (填元素符号)
(3)分子式为AD的化合物常以多聚体(AD)n的形式存在,请解释原因 .
(4)B和氮原子可形成化合物(BN)2 , (BN)2分子中中心原子的杂化方式为 , φ键和π键的个数之比为 , 空间构型为 .
(5)D﹣、X+、Y3+三种离子组成的化合物X3YD6 , 其中化学键的类型有;该化合物中存在一个复杂离子,该离子的化学式为 , 配位体是 .
(6)Y晶体的晶胞如图所示,晶胞边长为apm,则Y的配位数为 , 晶体的密度为g/cm3 . (用NA 表示阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图3表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应
D.图4表示将1.000mol/L氨水滴入20.00mL 1.000mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B.将湿润的红色石蕊试纸放入集有氨气的集气瓶中,试纸由红色变为蓝色,说明氨水呈碱性
C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D.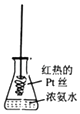
将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的直接氧化产物为NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题: 
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为 , 反应④的化学方程式为 .
(2)若A是常见的变价金属的单质,D、F是气态单质,反应④可以在光照条件下发生.反应①和反应②在水溶液中进行,反应②的离子方程式是
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 . 标准状况下3.36L物质E与含氢氧化钠10.0g的溶液充分反应,所得溶液中溶质成分为(写出化学式和对应的物质的量).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:X(g)+3Y(g)═2Z(g)△H<0,甲、乙为恒容、等体积的真空密闭容器,向甲中加入1molX和 3molY,在一定条件下达到平衡时放出热量为Q1KJ.在相同条件下,向乙容器中加入2molZ,达到平衡时吸收热量Q2KJ,已知 Q1=3Q2 . 下列叙述正确的是( )
A.平衡时甲、乙中Z的体积分数甲>乙
B.平衡时甲中X的转化率为75%
C.达到平衡后,再向乙中加入0.25molX,0.75molY和1.5molZ,平衡向生成x的方向移动
D.乙中反应的热化学方程式:2Z(g)═X(g)+3Y(g)△H=+Q2kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下: 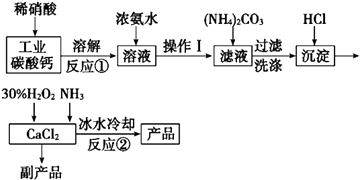
已知:CaO28H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全.
(1)写出反应①中氧化还原反应的离子方程式: .
(2)向反应①后的溶液中加浓氨水的目的是: , (用方程式表示)
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):①;② .
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c molL﹣1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.已知:I2+2S2O32﹣═2I﹣+S4O62﹣ .
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不受影响”“偏低”或“偏高”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计).其中能表示等质量的氢气与氦气的是( )
A.
B.
C.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com