
【题目】化学键的键能是形成(或断开)1 mol 化学键时释放(或吸收)的能量。已知白磷和 P4O6 的分 子结构如图所示:
现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O==O:498
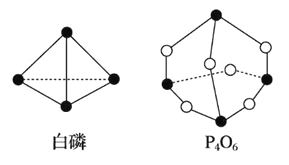
若生成 1 mol P4O6,则反应 P4(白磷)+3O2==P4O6 中的能量变化为
A. 吸收 1638 kJ 能量 B. 放出 1638 kJ 能量
C. 吸收 126 kJ 能量 D. 放出 126 kJ 能量
【答案】B
【解析】
反应热△H=反应物总键能-生成物总键能,据此计算判断.注意每摩尔P4中含有6molP-P键.
化学键的键能(kJ·mol-1):P—P:198 P—O:360 O===O:498,反应热△H=反应物总键能-生成物总键能,由图可知:1个P分子中含有6个P-P,1个P4O6分子中含有12个P-O,1mol P4和3mol O2完全反应(P4+3O2=P4O6)生成1molP4O6,所以反应P4+3O2=P4O6的反应热△H=6×198kJ·mol-1+3×498kJ·mol-1-12×360kJ·mol-1=-1638kJ·mol-1,反应放热1638kJ,故选B。


科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
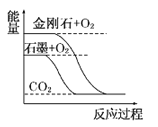
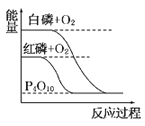
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g) ![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时各物质的浓度有可能是( )
A.X2为0.2 mol·L-1
B.Y2为0.45 mol·L-1
C.Z为0.35 mol·L-1
D.Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理下图所示,该装置工作时,下列叙述错误的是

A. b极上生成乙烯的电极反应式为:2CO2+12H++12e-===C2H4+4H2O
B. a接太阳能电池的正极
C. a级上发生还原反应生成标况下22.4 L氧气时,电路中转移的电子数为4NA
D. 溶液中H+通过质子透过膜向b极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
元素 | 相关信息 |
X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
Y | 原子核外电子有7种不同的运动状态 |
Z | 地壳中含量最高的元素 |
W | 价电子排布式为(n+1)sn(n+1)pn+2 |
R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
(1)基态R原子的电子排布式为______________________________________。
(2)Y2分子中σ键和π键的数目比为________________。
(3)X、Y、Z三种元素的第一电离能由小到大的顺序为____________(用元素符号表示),元素Y的简单气态氢化物的沸点比元素X的简单气态氢化物沸点高的主要原因是_____________。
(4)元素Z、W组成的微粒WZ42-的空间构型是______,其中W原子的杂化轨道类型为________。
(5)已知Z、R能形成一种化合物,其晶胞结构如图所示,该化合物的化学式为________;若相邻的Z原子和R原子间的距离为a cm,设阿伏加德常数的值为NA,则该晶体的密度为__________g·cm-3(用含a、NA的代数式表示)。
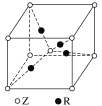
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中三个电解装置中都盛有相同体积、相同物质的量浓度的 CuSO4 溶液,通电一段 时间并且通过的电量相同时, CuSO 4 溶液物质的量浓度大小关系正确的是

A. ② > ③ > ① B. ① > ② > ③
C. ② = ③ > ① D. ① = ② = ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以说明氯元素的非金属性比硫元素的非金属性强的是( )
![]() 的溶解度比
的溶解度比![]() 的大
的大 ![]() 的氧化性比
的氧化性比![]() 的强
的强
![]() 的酸性比
的酸性比![]() 的强
的强 ![]() 比
比![]() 稳定
稳定
![]() 氯原子最外层有7个电子,硫原子最外层有6个电子
氯原子最外层有7个电子,硫原子最外层有6个电子
![]() 能与铁反应生成
能与铁反应生成![]() ,硫与铁反应生成FeS
,硫与铁反应生成FeS
![]() 可以从
可以从![]() 溶液中置换出S
溶液中置换出S ![]() 同浓度的HCl和
同浓度的HCl和![]() 的水溶液,前者酸性强
的水溶液,前者酸性强
![]() 或
或![]() 还原性比
还原性比![]() 或
或![]() 弱
弱
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):
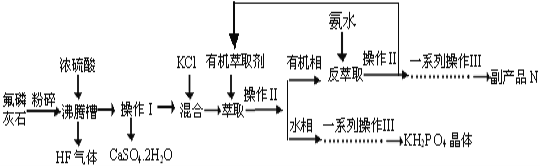
已知萃取的主要反应原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是___________________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括______________________________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4的质量为_______kg。
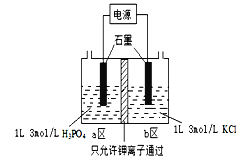
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a 区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是______________________________________。
(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com