
【题目】据国外资料报道,在独居石 (一种共生矿,化学成分为Ce、La、Nd等的磷酸盐)中,查明有尚未命名的116、124、126号元素.判断其中116号应位于周期表中的
A. 第六周期ⅣA族 B. 第七周期ⅥA族
C. 第七周期Ⅷ族 D. 第八周期ⅥA族
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1) 可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应
2NH3是工业上合成氨的重要反应
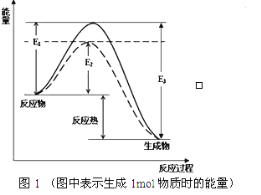
根据图1请写出合成氨的热化学方程式:_______________(热量用E1、E2或E3表示)。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为__________。
(3)氮化锂是非常有前途的储氢材料,其在氢气中加热中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
(4)LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠,已知电池放电时总反应式为FePO4+Li═LiFePO4 ,电池正极反应为____________________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
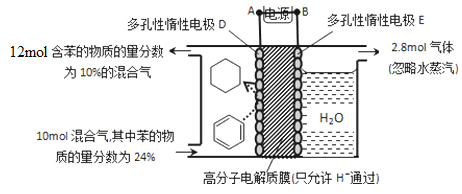
①导线中电子移动方向为____________。(用A、D表示)
②生成目标产物的电极反应式为__________________________。
③该储氢装置的电流效率![]() =__________________________。
=__________________________。
(![]() =
=![]() ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g) ![]() 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=________。
(2)乙容器中反应达到平衡时所需时间t________4 min(填“大于”、“小于”或“等于”)。
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8 mol/L,起始时,向丙容器中加入C、D的物质的量分别为3 mol、2 mol,还需加入A、B。其中需加入A、B的物质的量分别是 _________________。
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是____________。
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器体积和温度都不变,向甲中加入一定量的A气体
D.保持容器体积和温度都不变,向甲中加入一定量的B气体
(5) 该温度下,向体积为1L的密闭容器中通入A、B、C、D气体物质的量分别为3mol、1mol、3mol、2mol,此时反应___________________ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的溶液,在pH=0和pH=14的条件下都能大量共存的是( )
A.Na+、K+、SO![]() 、AlO2-
、AlO2-
B.Ca2+、Na+、SO![]() 、Cl-
、Cl-
C.Na+、K+、SO![]() 、NO
、NO![]()
D.K+、Na+、MnO![]() 、SO
、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用KMnO4酸性溶液与H2C2O4溶液反应中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 molL-1、0.0010 molL-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 molL-1)的用量均为4 mL。
(1)写出反应的离子方程式:
(2)请完成以下实验设计表:完成④的实验条件,并将实验目的补充完整。
实验 编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/molL-1 | 实验目的 |
① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究 对反应速率的影响 c. 实验①和④探究催化剂对反应速率的影响。 |
② | 298 | 0.5 | 0.001 | |
③ | 323 | 0.5 | 0.010 | |
④ |
(3)该反应的催化剂选择MnCl2还是MnSO4 ,简述选择的理由 。
(4)某同学对实验①和②分别进行了三次实验,测得以下数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间 t / min | ||
第1次 | 第2次[ | 第3次 | |
① | 12.8 | 13.0 | 11.0 |
② | 4.9 | 5.1 | 5.0 |
a、实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
b、该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液浓度越小,所需时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。
C、某同学认为不用经过计算,直接根据褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为应该如何设计实验 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是( )
A.2F2+2H2O=4HF+O2 B.Cl2+H2O=HCl+HClO
C.BrCl+H2O=HCl+HBrO D.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )
CO2(g)+H2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )

A.反应CO(g)+H2O(g)![]() CO2(g)+H2(g) 的△H>0
CO2(g)+H2(g) 的△H>0
B.在T2时,若反应处于状态D,则一定有v正<v逆
C.平衡状态A与C相比,平衡状态A的c(CO)小
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是( )
A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B.使用生物酶降解生活废水中的有机物,可防止水体的富营养化
C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念
D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol 由两种气态烃组成的混合物完全燃烧得0.28mol 二氧化碳和7.2g水。下列关于该混合物的说法正确的是
A. 一定含有甲烷 B. 一定含有乙烯 C. 可能含有乙烷 D. 可能含有乙炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com