
【题目】要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液③ 加入少量KSCN溶液
A.①②B.③②C.③①D.①②③
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+ NaClO=Na2CO3+N2H4·H2O+NaCl。据此,某学生设计了下列实验。
I、制备 NaClO溶液
实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
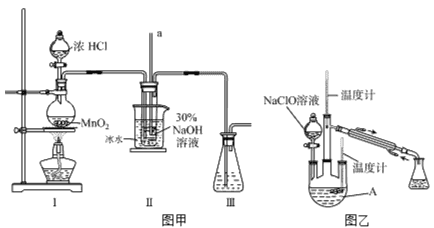
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_____________________________。
Ⅱ、制取水合肼
实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式________________________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(4)称取馏分0.3000g,加水配成20.0mL溶液,一定条件下用0.1500mol·L-1的I2溶液滴定。
已知:N2H4·H2O +2I2=N2↑+4HI+H2O
①滴定时,可以选用的指示剂为____________________;
②实验测得消耗I2溶液的平均值为20.00L,馏分中N2H4·H2O的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中加入2.0 mol SO2和1.0 mol O2,一定条件下发生如下反应2SO2+O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为( )
2SO3。反应达到平衡后,各物质的物质的量可能为( )
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 2.0 | 1.0 | 0 |
B | 0.20 | 0.10 | 1.80 |
C | 1.0 | 0.8 | 1.0 |
D | 0 | 0 | 2.0 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 金属铜中Cu原子堆积模型如图4为最密堆积每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构;
B. P4和CH4都是正四面体分子且键角都为109o28ˊ;
C. CO2、SO2都是直线形的分子
D. CH2=CH2分子中共有五个σ键和一个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为NA。下列叙述中正确的是 ( )
A. I L 0.1mol/L的FeCl3溶液中,H+的数目约为0.1NA
B. 1 mol金刚石中含有C-C键的数目为2NA
C. 7.8 g Na2O2中含有的阴离子数目约为0.2NA
D. 标准状况下,l L甲醇完全燃烧后生成的CO2分子个数约为(1/22.4)NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述不正确的是( )
A. 溶液和胶体的本质区别是否有丁达尔效应
B. 向氢氧化铁胶体中缓缓滴加稀硫酸,先产生沉淀,进而沉淀溶解
C. 用半透膜渗析的方法,可以分离胶体和溶液
D. 水泥厂、面粉厂通常利用胶体电泳进行高压静电除尘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行如下反应:X(g)+3Y(g)![]() 2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
A. X为0.25mol/L,Z为0.5mol/L B. Y为1.2mo1/L
C. X为0.3mol/L,Z为0.3mol/L D. Z为0.6mo1/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为1nm~l00nm的红褐色液相分散系。则该反应的化学方程式为____________________________。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL6mol/L的B溶液中逐滴滴入100mL某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为________________。
(3)将A、B中两种金属元素的单质用导线连接,插入一个盛有KOH溶液的烧杯中构成原电池,则电池反应为_______________________。
(4)C、D、E均是短周期中同一周期元素形成的单质或化合物,常温下D为固体单质,C和E均为气态化合物,且可发生反应:C+D![]() E。将一定量的气体C通入某浓度的KOH溶液得溶液F,向F溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(C)的关系如图所示,则生成F的离子方程式______________________。
E。将一定量的气体C通入某浓度的KOH溶液得溶液F,向F溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(C)的关系如图所示,则生成F的离子方程式______________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com