
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,22gCO2含有的氧原子数为NA
B.标准状况下,2.24 L CCl4含有的分子数为0.1NA
C.常温常压下,0.1molL-1的MgCl2溶液中含Cl-数为0.2NA
D.常温常压下,5.6g铁与足量Cl2完全反应,转移电子数为0.2NA
科目:高中化学 来源: 题型:
【题目】科研人员研制出透氧膜,它允许e-和O2-同时通过,可实现水连续分解制备氢气,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示,下列说法正确的是
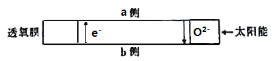
A.CO在a侧上反应
B.b侧的反应式:H2O+2e- = H2↑+ O2-
C.该透氧膜可实现太阳能向氢能的转化
D.当有2mol电子通过透氧膜时,就会消耗22.4L CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制VmL 2.0mol·L-1的氢氧化钠溶液,需要氢氧化钠固体质量______ g。 下列操作,会使所配的溶液浓度如何变化。
(1)称取氢氧化钠固体时将固体放在天平托盘的纸片上:______ ;
(2)称量时左码右物,且使用了游码:_______;
(3)容量瓶用蒸馏水洗净,没有烘干:________;
(4)没有等到溶液冷却到室温就将溶液注入容量瓶中:______;
(5)转移溶液时有溶液撒出:_____,
(6)没有用蒸馏水洗烧杯和玻璃棒:____,
(7)定容时仰视液面:_____,
(8)定容时俯视液面:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 2.1g丙烯中所含的共用电子对总数为0.3NA
B. 4.6gNO2和N2O4的混合气体中含有的氮原子数为0.1NA
C. 过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D. 在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)可用做净水剂、除草剂等。某研究小组测定了硫酸矿焙烧后的烧渣中主要成分(Fe2O3、Al2O3和SiO2,不考虑其它杂质)的含量并制备了绿矾,流程如下:
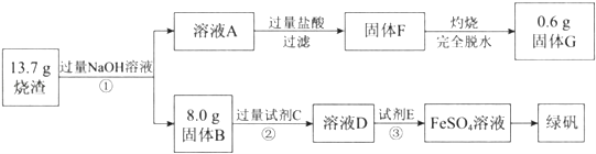
请回答下列问题:
(1)溶液A中含有的阴离子主要有AlO2-、SiO32-和______。
(2)试剂C是______。
(3)③中反应的离子方程式是_______、_______。
(4)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如右图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是
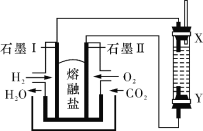
A. 石墨电极Ⅱ处的电极反应式为O2+4e-=2O2-
B. X是铁电极
C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D. 若将电池两极所通气体互换,X、Y两极材料也互换, 实验方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。部分化学键的键能如下表:
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/kJmol-1 | 946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO) (丙容器/span>)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率υ(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
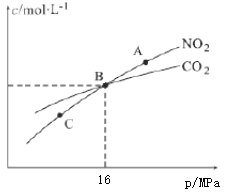
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是公认的零碳消洁能源,用乙醇为原料可通过多种方法制氢,具有理想的应用前景。回答下列问题:
(一)乙醇催化重整制氢
原理:C2H5OH(g)+3H2O(g)![]() 2CO2(g)+6H2(g)△H1
2CO2(g)+6H2(g)△H1
以Ni/凹凸棒石做催化剂,在2L刚性容器中,分别以水醇比为2:1、4:1、6:1、8:1投料(乙醇的起始物质的量相同),反应相同时间测得乙醇转化率随温度变化的关系如图所示。
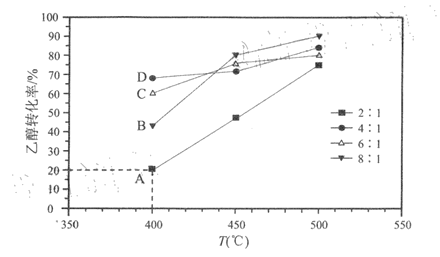
已知:过多的水分子会占据催化剂表面活性位,导致反应速率降低:上图中水醇比为2:1时,各点均已达到平衡状态。
(1)反应热△H1________0(填“>”或“<”)。若乙醇的起始物质的量为n0mol,则K(400℃)=______________(列出计算式)。
(2)400℃时,水醇比过高不利于乙醇转化的原因是____________________________;B、C、D三点中,一定未达到平衡状态的是______________(填标号)。
(二)乙醇氧化制氢
原理:C2H5OH(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+3H2(g) △H2
2CO2(g)+3H2(g) △H2
(3)已知H2(g)+![]() O2(g)
O2(g)![]() H2O(g) △H3,则△H2=_____(用含△H1和△H3的式子表示)。在密闭容器中通入一定量的乙醇和氧气,达到平衡状态后增大容器体积,则混合气体的平均相对分子质量将_________(填“增大”“减小”或“不变”)。
H2O(g) △H3,则△H2=_____(用含△H1和△H3的式子表示)。在密闭容器中通入一定量的乙醇和氧气,达到平衡状态后增大容器体积,则混合气体的平均相对分子质量将_________(填“增大”“减小”或“不变”)。
(三)乙醇电解法制氢
乙醇电解法不仅可以利用乙醇本身的氢,还可以从水中获得氢,且电解乙醇所需电压比电解水的理论电压要低很多。
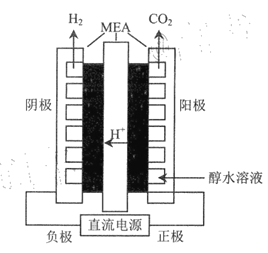
(4)利用如图所示装过(MEA为复杂的膜电极)电解乙醇制氢,阳极的电极反式应为___________,理论上每转移lmol电子,可以产生________L氢气(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com