
一定条件下,反应:6H2+2CO2 C2H5OH+3H2O的数据如下图所示
C2H5OH+3H2O的数据如下图所示
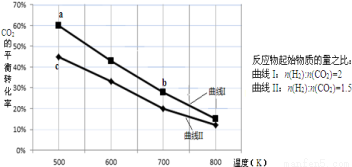
下列说法正确的是
A.该反应的△H>0
B.达平衡时,3v(H2)正=v(CO2)逆
D.b点对应的平衡常数K值大于c点
C.a点对应的H2的平衡转化率为90%
科目:高中化学 来源:2016届福建省高三下热身考理综化学试卷(解析版) 题型:实验题
钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
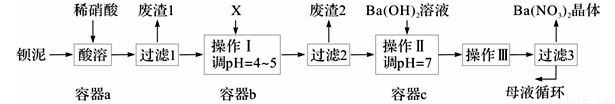
已知:i .Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii .Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii. Kap(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)Ba(FeO2)2中Fe的化合价是 。
(2)二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 。
(3)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理: 。
(4)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(5)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(6)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(7)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春十一高三下考前冲刺理综化学试卷二(解析版) 题型:简答题
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___________;
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中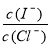 为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________ kJ。
H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________ kJ。
(4)Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
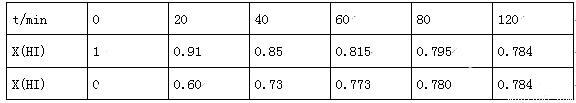
①根据上述实验结果,该反应的平衡常数K的计算式为:___________;
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为___________(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=___________min-1.
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为___________(填字母).
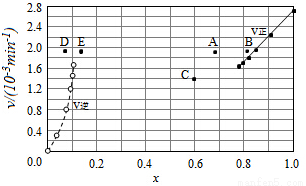
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三毕业班最后一卷理综化学试卷(解析版) 题型:选择题
据2015年 4月 10 的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池。他们发现了一种新型石墨材料——泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体——即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物。如图:
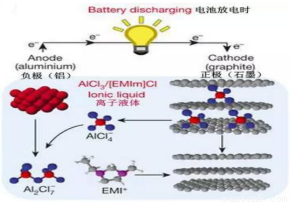
关于该电池的说法不正确的是( )
A.放电时,铝电极的电极反应式为:Al+7AlCl4—-3e—=4Al2Cl7—
B.[EMIm]Cl中既含离子键,又含共价键
C.电子流向为:石墨通过离子液体流向铝
D.充电时石墨电极的电极反应式为:Cn[AlCl4]-e—=Cn+ AlCl4—
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:填空题
新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,价电子的电子排布式_________________,价电子所在电子层的轨道数______;
②LiBH4由Li+和BH4-构成,BH4-的空间构型是___________,B原子的杂化轨道类型是______;
③Li、B、Cl元素的电负性由大到小排列顺序为______________;
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:

M是_______(填元素符号);
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞边长a=480pm,Na+半径为104pm,H-的半径________pm,NaH的理论密度是_______________g•cm-3。(用NA表示)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:选择题
扑热息痛的结构如图所示 下列关于扑热息痛的描述正确的是
下列关于扑热息痛的描述正确的是
A.分子式为C8H10NO2
B.扑热息痛易溶于水
C.能与Na2CO3溶液反应,但不能与NaHCO3溶液反应
D.属于芳香烃
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:选择题
下列有关化学用语表达正确的是
A.质子数为7、中子数为8的氮原子:87N
B.溴化铵的电子式: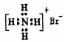
C.乙酸的比例模型:
D.间硝基甲苯的结构简式: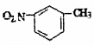
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高一下期中化学试卷(解析版) 题型:选择题
下列有关化学反应速率的说法不正确的是 ( )
A、升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间
B、化学反应达到最大限度时,正逆反应速率也达到最大且相等
C、用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率
D、用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一下第二次月考化学试卷(解析版) 题型:选择题
氯的原子序数为17,37Cl和35Cl是氯的两种同位素,下列说法正确的是( )
A. 35Cl原子所含质子数为18 ,37Cl和35Cl得电子能力相同
B. 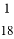 mol的H35Cl分子所含中子数约为6.02×1023
mol的H35Cl分子所含中子数约为6.02×1023
C. 7 g的35Cl2气体的体积为2.24 L
D. 35Cl的相对原子质量是12C原子质量的35倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com