
| A. | 氢气分子内每个氢原子都达到了8电子稳定结构 | |
| B. | 1 mol H2的能量比2 mol H的能量低 | |
| C. | 1 mol H2离解成2 mol H要放出437.6 kJ热量 | |
| D. | 氢原子不如氢分子活泼 |
分析 氢分子中两个氢原子 以一对共用电子对形成共价键,氢原子都达到了2电子的稳定结构;原子不能独立存在,比分子活泼,分子的能量低于原子的能量;已知2H→H2并放出437.6kJ的热量,所以1molH2离解成2molH要吸收437.6kJ热量.
解答 解:A、氢气分子内每个氢原子都达到2电子稳定结构,故A错误;
B、分子的能量比原子的能量低,故B正确;
C、根据已知2H→H2并放出437.6kJ的热量,所以1molH2离解成2molH要吸收437.6kJ的热量,故C错误;
D、原子比分子能量高,氢气分子稳定,故D错误;
故选B.
点评 本题考查了反应中能量转化的原因,分子原子的能力高低,原子结构的特征.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

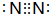 ;并写出由b生成c的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
;并写出由b生成c的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
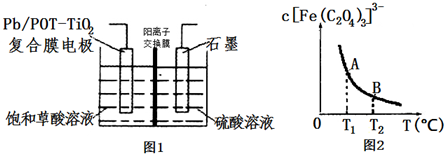
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com