
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 ,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.分析 (1)①过氧化钠是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,过氧化钠与水反应生成氢氧化钠与氧气;
②能使H2O2产生气体通常用MnO2作催化剂,据此答题;
(2)①测知溶液显酸性,说明溶液中肯定含有H+,而H+与CO32-反应发生反应而不能共存;
②CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-,而与I-反应的离子不能共存;
③另取样滴加稀NaOH溶液,溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Fe3+、Mg2+、Al3+能与碱反应产生沉淀,与现象矛盾;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀,说明溶液中肯定含有Ba2+;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝根据澄清溶液得,气体为氨气,据此解答即可.
解答 解:(1)①过氧化钠是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为: ,过氧化钠与水反应生成氢氧化钠与氧气,离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;
,过氧化钠与水反应生成氢氧化钠与氧气,离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;
故答案为: ;2Na2O2+2H2O=4Na++4OH-+O2↑;
;2Na2O2+2H2O=4Na++4OH-+O2↑;
②能使H2O2产生气体通常用MnO2作催化剂;
故答案为:MnO2;
(2)①溶液呈强酸性,说明溶液中肯定含有H+,而H+与CO32-反应发生反应而不能共存,说明溶液中肯定不含有CO32-;
②CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-,而I-与Fe3+、NO3-和H+能发生氧化还原反应,而不能共存,说明溶液中肯定不含有Fe3+、NO3-;
③溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Fe3+、Mg2+、Al3+能与碱反应产生沉淀,说明溶液中肯定不含有Fe3+、Mg2+、Al3+;
④取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+,而Ba2+能与SO42-产生沉淀,说明溶液中不含SO42-;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则说明一定含有NH4+,
综上所述:一定存在的离子是H+、NH4+、Ba2+、I-,一定不存在的离子是Mg2+、Al3+、Fe3+、SO42-、CO32-、NO3-,不能确定的离子为:K+、Cl-;
故答案为:H+、NH4+、Ba2+、I-;K+、Cl-.
点评 本题以物质的性质为背景,考查了离子方程式书写、实验分析、物质的检验及鉴别等知识点,为高频考点,把握常见离子之间的反应、离子检验等为推断的关键,侧重分析与推断能力的综合考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+稀HNO3 | B. | Cu$\stackrel{空气、△}{→}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | Cu$\stackrel{Cl_{2}}{→}$CuCl2 $\stackrel{AgNO_{3}}{→}$ Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
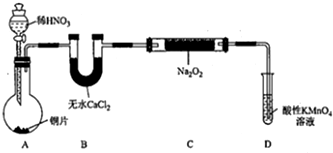
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5ml待测液加入维生素C,振荡,再加入1mlM溶液,加入至蒸馏水10mL,再振荡,与③好色阶对比 | 紫红色比③色阶浅 | 维生素C可以有效降低NaNO2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
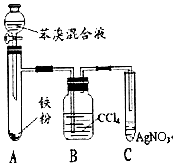 已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置.
已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | B. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | ||
| C. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | D. | $\frac{115{w}_{2}-84{w}_{1}}{31{w}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | X的最高价氧化物对应的水化物中只含有共价键 | |
| C. | X、Z形成的化合物一定为离子化合物 | |
| D. | 工业上常用Y的氯化物为原料制取单质Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com