
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
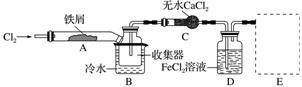
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为_________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是___________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为__________________________________;
装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:__________________________________。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为___________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________________。
(8)综合分析实验 Ⅱ 的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②________________________________________________________________________。
答案 (1)2Fe+3Cl2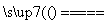 2FeCl3
2FeCl3
(2)在沉积的FeCl3固体下方加热
(3)②⑤
(4)冷却,使FeCl3沉积,便于收集产品 干燥管
K3[Fe(CN)6]溶液
(6)2Fe3++H2S===2Fe2++S↓+2H+
(7)Fe2+-e-===Fe3+
(8)FeCl3得到循环利用
解析 (1)装置A中进行的是Fe与Cl2制取FeCl3,反应的化学方程式为2Fe+3Cl2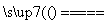 2FeCl3。
2FeCl3。
(2)由于FeCl3沉积在反应管A右端,时间长了会堵塞,所以应在此处进一步加热使FeCl3再次升华进入收集装置。
(3)通入干燥氯气可排出空气以及其中所含的水蒸气,反应完毕后将多余Cl2赶出,将收集器密封以防吸收空气中的水蒸气从而避免了FeCl3的潮解。
(4)通过冷水浴将升华的FeCl3冷却收集,Fe2+的检验可通过与赤铁盐(K3[Fe(CN)6])生成蓝色沉淀(腾化盐)的方法来完成。
(6)Fe3+与H2S的氧化还原反应的离子方程式的书写应注意得失电子守恒与电荷守恒。
(7)、(8)电解FeCl2溶液,通过阴极:2H++2e-===H2↑
阳极:Fe2+- e-===Fe3+来完成溶液中FeCl3的循环利用。


科目:高中化学 来源: 题型:
有关金属的腐蚀与防护的叙述正确的是( )
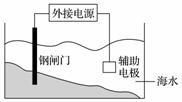
A.金属的化学腐蚀比电化学腐蚀普遍
B.上图装置的原理是“牺牲阳极的阴极保护法”
C.金属腐蚀的本质是M-ne-===Mn+而被损耗
D.用铝质铆钉来接铁板,铁板易被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为( )
①加入足量氯水 ②加入足量酸性KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外研究小组用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为
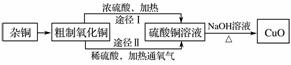
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是________(填字母)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.Fe在一定条件下与水反应生成H2和Fe(OH)3
B.Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显血红色
C.FeCl2溶液蒸干灼烧后得到FeCl2固体
D.将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:

请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是________。
(2)步骤②中,除发生反应Fe+2HCl===FeCl2+H2↑外,其他可能反应的离子方程式为________________。
(3)溶液C的颜色是________,溶液D中可能含有的金属阳离子有________。
(4)可以验证溶液B中是否含有Fe2+的一种试剂是______(填字母)。
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液
(5)操作乙的名称是________,步骤⑤产生金属铜的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中各有两种组分,两组分各取1,在足量氧气中燃烧,两者耗氧量不相同的是 ( )。
A.乙烯和乙醇 B.乙炔和乙醛
C.乙烷和乙酸甲酯 D.乙醇和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
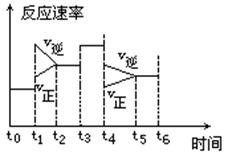 在一密闭体系中发生下列反应:
在一密闭体系中发生下列反应:
N2 +3H2  2NH3 ΔH<0 ,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 ΔH<0 ,下图是某一时间段中反应速率与反应进程的曲线关系图:
回答下列问题:
(1)处于平衡状态的时间段是______.
(2)t1、t3、t4时刻体系中分别对应的条件变化为:
, , ;
(3)下列各时间段时,氨的百分含量最高的是______.
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)对于上述反应,起始时加入1mol N2和3mol H2,在恒温恒压条件下反应达到平衡时生成a mol NH3,在恒温恒容条件下,达到平衡时生成b mol NH3,则a和b的大小关系为( )
(5)对于上述反应,在恒温恒容条件下,起始时充入2mol N2和3mol H2,达到平衡时生成b mol NH3,若相同条件下,起始时充入x mol N2,y mol H2, z mol NH3, 达到平衡时混合物中各组分的百分含量不变,则x y z 取值必须满足的一般条件为: , ;
(一个只含x, z;另一个只含y, z)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com