
【题目】蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在。
(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是___;基态硫原子的价电子排布式为______。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为____(填化学式)。1 mol CN-中含有的π键的数目为____。
(3)蛋白质分子中氨基(—NH2)氮原子的轨道杂化类型是_____;血液中有一种含铜的呈蓝色的蛋白质分子,与Cu同周期且最外层电子数相等的元素还有______(填元素符号)。
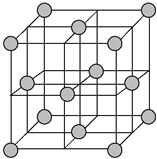
(4)铜晶体为面心立方最密堆积,即在晶体结构中可以分割出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个面上,已知铜的原子半径为127.8 pm,列式计算晶体铜的密度:ρ=___g·cm-3(列出计算式即可)。
![]()
【答案】N<O 3s23p4 CO2或N2O 2NA sp3 K、Cr ![]()
【解析】
(1)非金属性越强,电负性越大;S元素处于第三周期VIA族;
(2)与SCN-互为等电子体,应含有3个原子,且最外层电子数相同;CN-与N2互为等电子体,二者结构相似,故 CN-离子中形成C≡N三键;
(3)蛋白质分子中氨基(-NH2)氮原子形成3个σ键,含有1对孤对电子,N原子杂化轨道数目为4;与Cu同周期且最外层电子数相等的元素原子外围电子排布为4s1、3d54s1;
(4)晶胞为面心立方密堆积,晶胞面对角线上的Cu原子相邻,则晶胞棱长为127.8pm×4×![]() =
=![]() ×127.8pm,根据均摊法计算晶胞中Cu原子数目,表示出晶胞质量,再根据ρ=
×127.8pm,根据均摊法计算晶胞中Cu原子数目,表示出晶胞质量,再根据ρ=![]() 计算晶胞密度。
计算晶胞密度。
(1)非金属性越强,电负性越大,故电负性:N<O;S元素处于第三周期VIA族,基态硫原子的价电子排布式为3s23p4;
(2)与SCN-互为等电子体,应含有3个原子,且最外层电子数相同,故为CO2或N2O等; CN-与N2互为等电子体,二者结构相似,故 CN-离子中形成C≡N三键,1mol CN-中含有的π键的数目为2NA;
(3)蛋白质分子中氨基(-NH2)氮原子形成3个σ键,含有1对孤对电子,N原子杂化轨道数目为4,N原子轨道的杂化类型是sp3;与Cu同周期且最外层电子数相等的元素原子外围电子排布为4s1、3d54s1,分别为K、Cr;
(4)晶胞为面心立方密堆积,晶胞面对角线上的Cu原子相邻,则晶胞棱长为127.8pm×4×![]() =
=![]() ×127.8pm,晶胞中Cu原子数目为8×
×127.8pm,晶胞中Cu原子数目为8×![]() +6×
+6×![]() =4,晶胞质量为4×
=4,晶胞质量为4×![]() g,则晶胞密度4×
g,则晶胞密度4×![]() g÷(
g÷(![]() ×127.8×10-10cm)3=
×127.8×10-10cm)3=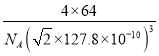 gcm-3。
gcm-3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是______。
A.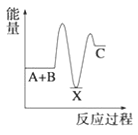 B.
B.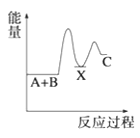
C.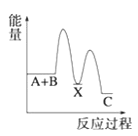 D.
D.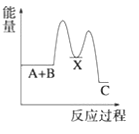
(2)①合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量,已知(见图1):则1molN﹣H键断裂吸收的能量约等于______kJ。
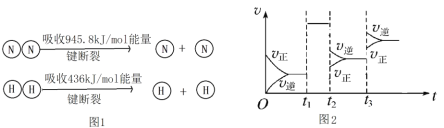
②图2t2时刻改变的条件是______,t3时刻改变的条件是______。
③某温度下,若把10molN2与30molH2置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则氮气的转化率______。
④绝热恒容条件下,可以作为判断该反应达到平衡状态的依据是_____。
A.容器内气体的总压强保持不变
B.H2、N2的反应速率比为3∶1
C.容器内气体的平均摩尔质量保持不变
D.容器内气体的温度保持不变E.容器内气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。

(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl气体溶解在1 L水中(水的密度为1 g·cm-3),所得溶液的密度为ρ g·cm-3,质量分数为w,物质的量浓度为c,NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.所得溶液的物质的量浓度:c=1 mol·L-1B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有体积为22.4 LD.所得溶液的溶质质量分数:w=![]() ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是
A. NaHCO3:NaHCO3 ![]() HCO3-+ Na+
HCO3-+ Na+
B. CH3COONH4:CH3COONH4 = NH4++CH3COO-
C. NaHSO4:NaHSO4 = Na+ +HSO4-
D. Fe(OH)3:Fe(OH)3 ![]() Fe(OH)2++2OH-
Fe(OH)2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )
2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )

A. t5~t6时氨气的体积分数最大 B. t3时升高了温度
C. t1时加入催化剂 D. t4时减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1mol·L-1NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列关系:![]() <1
<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是

A. 此反应无光照也可发生
B. 甲烷和Cl2反应后的产物只有CH3Cl和HCl
C. 盛放饱和食盐水的水槽底部会有少量晶体析出
D. CH4和Cl2完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
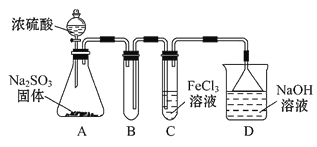
(1)通入足量SO2时C中观察到的现象为_____________________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42。该做法_______(填“合理”或“不合理”),理由是____________。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com