
下列对于溶液中的问题叙述正确的是( )
A.向冰醋酸中加水至配成醋酸稀溶液的过程H+的浓度逐渐减小
B.在稀溶液中:H+(aq) + OH-(aq) = H2O(l); △H=-57.3kJ/mol,则含1 mol HClO的稀溶液和含1 mol KOH的稀溶液完全反应放出的热量等于57.3 kJ
C.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
D.常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH-—→2CO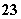 +12H2O+14e-、7H2O+7/2O2+14e-—→14OH-,有关此电池的推断正确的是( )
+12H2O+14e-、7H2O+7/2O2+14e-—→14OH-,有关此电池的推断正确的是( )
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中,CO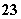 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。
请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式______________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物的化学式分别是________,其中最不稳定的是________。
(3)它们的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的化学式________,电子式________,结构式________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中可能含有①Na+ ②Ba2+ ③Cl- ④Br- ⑤SO32- ⑥SO42-中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤序号 | 操 作 步 骤 | 现 象 |
| (1) | 用pH试纸检验 | 溶液的pH>7 |
| (2) | 向溶液中滴加氯水,再加入CCl4、振荡、静置 | 下层呈橙色 |
| (3) | 向(2)所得水溶液加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
下列结论正确的是( )
A.不能确定的离子是① B.肯定含有的离子只有④⑤
C.肯定没有的离子是②⑤ D.不能确定的离子是③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是( )
A. NH5中既有共价键、又有离子键,是离子化合物
B. 1molNH5中有5NA个N—H键(NA为阿伏加德罗常数)
C.NH5跟水的反应是氧化还原反应
D.NH5跟水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是海水中含量较多的金属,镁合金及其镁的化合物
用途非常广泛。
(1)“镁-次氯酸盐”燃料电池的装置如右图所示,
该电池的正极反应式为 。
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g) = MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) = Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) 的△H3= 。
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

(1)①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。


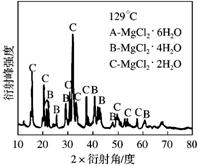
测得E中Mg元素质量分数为60.0%,则E的化学式为 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 。
(4)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2 +2A1+3H2↑
每生成27gAl转移电子的物质的量为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
等量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A.1:1 B.3:4
C.2:3 D.4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的性质决定了物质的用途,下面列出了金属的几种性质:①导热性 ②导电性 ③还原性 ④延展性 ⑤具有金属光泽。请在下面金属用途后的横线上填上金属性质对应的序号。
(1)用铝锭制成包装用的铝箔________;
(2)用铝制成的高压铝锅________;
(3)用铁粉回收照相业废液中的银________;
(4)电信业中大量使用的铜丝、金属电缆________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05 mol B.1 mol C.1.05 mol D.0.13 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com