

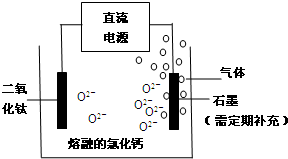
分析 (1)①沸腾炉中反应物为氯气、碳和TiO2,反应生成TiCl4和一氧化碳,再根据原子守恒配平;
②已知:Ⅰ. Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ/mol;
Ⅱ.2Na(s)+Cl2(g)=2NaCl(s)△H=bkJ/mol;
Ⅲ.Na(s)=Na(l)△H=ckJ/mol,
根据盖斯定律,2×Ⅱ-I-Ⅲ×4可得:TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s);
③TiCl4遇水强烈水解,Ti表现正价,应结合氢氧根,Cl表现负价,应结合H离子,反应生成Ti(OH)4与HCl;
(2)TiO2直接电解法生产钛,发生还原反应,二氧化钛为阴极,连接电源负极,由示意图可知二氧化钛获得电子生成Ti与氧离子;石墨为阳极,阳极发生氧化反应,氧离子在阳极获得电子生成氧气,会与石墨反应生成CO等有毒气体,石墨改为某金属陶瓷电极并通入一种还原性气体,反应后的生成物没有污染,可以是生成水;
(3)A.较低温度下有利于反应正向进行,高温下有利于反应逆向进行,说明正反应为放热反应;
B.高于400℃,钛和碘反应生成TiI4,大于1250℃TiI4分解;
C.在提纯过程中,高于400℃,钛和碘反应生成TiI4,大于1250℃TiI4分解,所以I2的作用是将粗钛从低温区转移到高温区;
D.高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,可以循环利用.
解答 解:(1)沸腾炉中反应物为氯气、碳和TiO2,反应生成TiCl4和一氧化碳,反应的化学方程式为:TiO2+2C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$TiCl4+2CO;
②已知:Ⅰ. Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ/mol;
Ⅱ.2Na(s)+Cl2(g)=2NaCl(s)△H=bkJ/mol;
Ⅲ.Na(s)=Na(l)△H=ckJ/mol,
根据盖斯定律,2×Ⅱ-I-Ⅲ×4可得:TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s),故△H=(2b-4c-a)kJ/mol;
故答案为:(2b-4c-a);
③TiCl4遇水强烈水解,Ti表现正价,应结合氢氧根,Cl表现负价,应结合H离子,反应生成Ti(OH)4与HCl,反应方程式为:TiCl4+4H2O=Ti(OH)4↓+4HCl↑,
故答案为:TiCl4+4H2O=Ti(OH)4↓+4HCl↑;
(2)TiO2直接电解法生产钛,发生还原反应,二氧化钛为阴极,连接电源负极,由示意图可知二氧化钛获得电子生成Ti与氧离子,阴极电极反应式为:TiO2+4e-=Ti+2O2-,石墨为阳极,阳极发生氧化反应,氧离子在阳极获得电子生成氧气,会与石墨反应生成CO等有毒气体,石墨改为某金属陶瓷电极并通入一种还原性气体,反应后的生成物没有污染,可以是生成水,所以该气体是氢气,
故答案为:负;TiO2+4e-=Ti+2O2-;H2;
(3)A.较低温度下有利于反应正向进行,高温下有利于反应逆向进行,说明正反应为放热反应,则该反应正反应的△H<0,故A错误;
B.高于400℃,钛和碘反应生成TiI4,大于1250℃TiI4分解,故B错误;
C.在提纯过程中,高于400℃,钛和碘反应生成TiI4,大于1250℃TiI4分解,所以I2的作用是将粗钛从低温区转移到高温区,故C正确;
D.在提纯过程中,高于400℃,钛和碘反应生成TiI4,大于1250℃TiI4分解生成碘和钛,所以I2可以循环利用,故D正确;
故选:CD.
点评 本题以金属的冶炼为载体,考查反应热计算、电解原理、化学平衡移动、信息获取等问题,侧重考查学生分析解决问题钠离子、信息获取与知识移运用,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶物 | CaF2 | CaC2O4 |
| Ksp | 3.5×10-11 | 2.3×10-9 |
| 酸 | HF | H2C2O4 |
| 电离常数 | Ka=7.2×10-4 | Ka1=5.4×10-2 Ka2=5.4×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CH4、N2等均是造成温室效应的气体 | |
| B. | “地沟油”经过加工处理后,可以用来制造燃油 | |
| C. | 铁粉、生石灰、硅胶是食品包装中常用的干燥剂 | |
| D. | 目前加碘食盐主要添加的是KI |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氕(${\;}_{1}^{1}$H)和氘(${\;}_{1}^{2}$H) | B. | O2和O3 | ||
| C. | 水和冰 | D. | NO和NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com