
科目:高中化学 来源: 题型:
右图是一种稀硫对Fe-Gr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
A.稀硫酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)—Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硫酸对Fe-Cr合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新疆乌鲁木齐八中高三第一次月考化学试卷(解析版) 题型:选择题
如图是稀酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
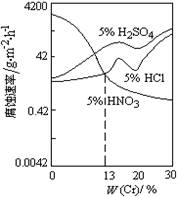
A.稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)= Fe(NO3)3 + 3NO2↑+ 3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省高三上学期第三次月考化学试卷 题型:选择题
如图是稀酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果.
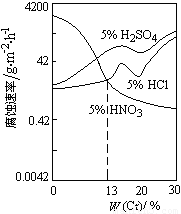
下列有关说法正确的是( )
A.稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)= Fe(NO3)3 + 3NO2↑+ 3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源:2010年湖南省高三上学期第二次月考化学试题 题型:选择题
下图是三种稀酸对Fe–Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是

A.稀硝酸对Fe–Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:
Fe+6HNO3(稀)==Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe–Cr合金的腐蚀性最强
D.随着Cr含量的增加,稀硝酸对Fe–Cr合金的腐蚀性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com