
| 1 |
| 1.6 |
| C(H +)C(Cl -)C(HClO) |
| C(Cl 2) |
| 0.03��0.03��0.03 |
| 0.06 |
| 1 |
| 1.6 |
| 1 |
| 1.6 |
| 0.75mol��3 |
| 3mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol��0.2mol��0.1mol |
| B��0.2mol��0.3mol��0.2mol |
| C��0.1mol��0.5mol��0.2mol |
| D��0.1mol��0.3mol��0.1mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
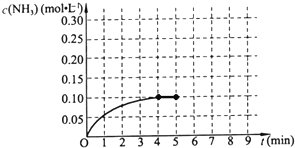 ��һ�ݻ�Ϊ2L���ܱ������У�����0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��
��һ�ݻ�Ϊ2L���ܱ������У�����0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����AgCl�ij����ܽ�ƽ����ϵ�У���������ˮ��Ksp��AgCl������ |
| B����ֱ�Ӹ���Ksp����ֵ��С�Ƚ���������ˮ�е��ܽ�ȴ�С |
| C����CaCO3�ij����ܽ�ƽ����ϵ�У�����ϡ���ᣬƽ�ⲻ�ƶ� |
| D��25��ʱ��Ksp��AgCl����Ksp��AgI������AgCl������Һ�м���KI��Һ���л�ɫ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �ŵ� |
| ��� |
| A����صĵ��ҺΪ������Һ������ΪNi2O3������ΪFe |
| B����طŵ�ʱ��������ӦΪFe+2OH--2e-=Fe��OH��2 |
| C����س������У�����������Һ��pH���� |
| D����س��ʱ��������ӦΪ2Ni��OH��2+2OH--2e-=Ni2O3+3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com