
����Ŀ��ˮ���������Ǵ������������Ҫ�ɷ�,�о��仯ѧ��ɶ�������������Ⱦ�����ش����壬ij�������������ᆳ�������Ҫ��Ԥ�������������Һ��������ɫ����ȷ��������������NH4+��Na+��Mg2+��Ca2+��Al3+��SO42-��NO3-��CO32-��Cl-��ijͬѧ�����ٽ������µ�ʵ��:
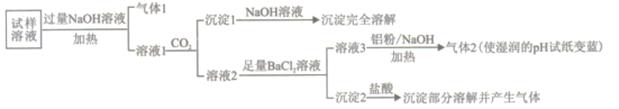
��֪���ڼ�����ǿ����������,�����ʿ��Խ�NO3-��ԭΪ������
�ش���������:
��1��������1���ĵ���ʽΪ_________��
��2������������1�������ӷ���ʽΪ________��
��3��������2���ijɷ���___________(�ѧʽ)��
��4������Һ3![]() ����2�������ӷ���ʽΪ_________��
����2�������ӷ���ʽΪ_________��
��5����������ʵ����ƶϸõ���������������__________�����ϵ�(�����ӷ���)��
��6����֪�����������и�Ԫ�ص���Ⱦ�������±�:
Ԫ�� | N | S | Na��Mg��Cl | Al | Ca |
��Ⱦ���� | ������β�� | ȼú��Ⱦ | �������� | �����ﳾ | �����۳� |
����ʵ�������жϸõ���������������Ⱦ������___________��
���𰸡� ![]() [Al(OH)4]-+CO2=A l(OH)3��+HCO3- BaSO4��BaCO3 8Al+3NO3-+5OH-+18H2O
[Al(OH)4]-+CO2=A l(OH)3��+HCO3- BaSO4��BaCO3 8Al+3NO3-+5OH-+18H2O ![]() 3NH3��+8[Al(OH)4]- Mg2+��Ca2+��CO32- ������β����ȼú��Ⱦ�������ﳾ
3NH3��+8[Al(OH)4]- Mg2+��Ca2+��CO32- ������β����ȼú��Ⱦ�������ﳾ
����������1������֪��������Һ�е�NH4+�����NaOH��Һ��Ӧ�����Ȳ���������1Ϊ����(NH3)���ʵ���ʽΪ��![]() ��
��
��2��������Һ�е�Al3+�����NaOH��Һ��Ӧ����[Al(OH)4]-��[Al(OH)4]-��CO2��Ӧ����Al(OH)3������Al(OH)3������NaOH��Һ��Ӧ����[Al(OH)4]-�������ܽ⣬���Գ���1ΪAl(OH)3������������1�������ӷ���ʽΪ��[Al(OH)4]-+CO2=Al(OH)3��+HCO3-��
��3�������̣�����2�м����ᣬ���������ܽⲢ�������壬�����֪������ɫ�������ɵã�����2ӦΪBaSO4��BaCO3�Ļ���
��4�������У���Һ3�������ۺ�NaOH�����������ɵ�����2��ʹʪ���pH��ֽ������������2Ϊ����������֪���ڼ�����ǿ�����������������ʿ��Խ�NO3-��ԭΪ��������������Һ3![]() ����2�������ӷ���ʽΪ��8Al+3NO3-+5OH-+18H2O
����2�������ӷ���ʽΪ��8Al+3NO3-+5OH-+18H2O![]() 3NH3��+8[A1(OH)4]-��
3NH3��+8[A1(OH)4]-��
��5������������Һ�ӹ���NaOH��Һû�в����������ɵ�Mg2+�����ϵͣ����ݳ���1��ȫ�ܽ���NaOH��Һ���ɵó���1��û��CaCO3��Ca2+��CO32-�����ϵͣ����Ը�������ʵ����ƶϸõ���������������Mg2+��Ca2+��CO32-�����ϵ���
��6������ʵ�������жϸõ���������������Mg2+��Ca2+��CO32-�����ϵͣ���ϱ����ṩ����Ϣ�ɵã�������β����ȼú��Ⱦ�������ﳾ�Ǹõ���������������Ⱦ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������״̬�����ʣ����ܵ��������ڵ���ʵ��ǣ� ��
A.�Ȼ�þ����B.������������C.ͭD.�Ȼ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���Fe��Cu��Ũ���ṹ��ԭ��أ�������_____(����Cu������Fe��)����Zn��Ag��ϡ���ṹ��ԭ��أ���������_____��Ӧ(������������ԭ��)��������ͬ��ͭ����п���õ������Ӻ����CuSO4��Һ�У�һ��ʱ���ȡ��ϴ�����������������������Ϊ12.9g��������ͨ���ĵ��ӵ����ʵ�����____mol��
(2)������������(KOHΪ�����)ȼ�ϵ��(��������Ϊ������Ҫ�ɷ�)������ת���ʸߡ���֪������Ч�ʿ��õ�λ������ȼ���ṩ�ĵ�������ʾ��������������(KOHΪ�����)ȼ�ϵ�ء���������������(KOHΪ�����)ȼ�ϵ��(��������Ϊ������Ҫ�ɷ�)�ĵ���Ч��֮��Ϊ____��
(3)һ���¶��£���3molA�����1molB����ͨ��һ�ݻ��̶�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L��xΪ_____������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ��____0.8mol/L(�������ڣ�С�ڻ������)������֪��ƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0������p0��p����ʾ��ƽ��ʱ��Ӧ��A��ת����Ϊ________��
xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L��xΪ_____������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ��____0.8mol/L(�������ڣ�С�ڻ������)������֪��ƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0������p0��p����ʾ��ƽ��ʱ��Ӧ��A��ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������aA��g��+bB��g��cC��g����Ӧ���ı�ijһ�������������õ���ͼ��p ��ʾѹǿ��T ��ʾ�¶ȣ�n ��ʾ���ʵ������� ��ʾƽ��ת���ʣ�������ͼ�������ж���ȷ���ǣ�������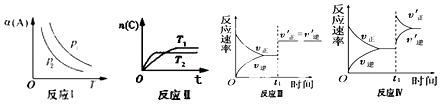
A.��Ӧ I���� p1��p2 �� �� a+b��c
B.��Ӧ�˷�Ӧ�ġ�H��0���� T1��T2
C.��Ӧ��ʾt1 ʱ��һ����ʹ�ô����Է�Ӧ���ʵ�Ӱ��
D.��Ӧ������ʾt1ʱ������ B ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£���Ӧ����һ���ܴ���������ǣ�������
A.��0.1mol/LNaHCO3��Һ�У�Al3+��NH4+��SO42����NO3��
B.�����£� ![]() =0.1mol/L����Һ�У�K+ �� Cl�� �� Fe2+ �� NO3��
=0.1mol/L����Һ�У�K+ �� Cl�� �� Fe2+ �� NO3��
C.ʹ���ȱ�����Һ�У�NH4+ �� Cl�� �� SO2�� �� Mg2+
D.25��ʱ��ˮ�������c��H+��=1��10��13mol/L��K+ �� Ba2+ �� NO3�� �� S2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.ֽ¨�Ż���ˮ������Ϊˮ�ܽ��Ϳ�ȼ����Ż��
B.С�մ�����θ����࣬��ΪС�մ����к�����
C.������ʳƷ���ʼ�����Ϊ��������������ˮ��Ӧ
D.�����ֵ����ܲ�ͬ����Ϊ�����ĺ�̼���ȸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������װ�ý����Ҵ���������ʵ�飬��ش��������⣺
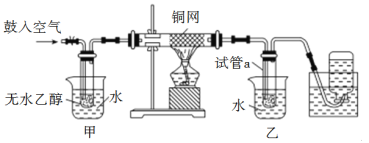
��1����д��ͭ����������Ӧ�Ļ�ѧ��Ӧ����ʽ_____________����Ϩ��ƾ��ƣ����ϵع����������Ӧ���ܼ������У�˵���÷�Ӧ��_______��Ӧ������ȡ����ȡ�����
��2������������ˮԡ�����ò���ͬ����������_____________��
��3����Ӧ����һ��ʱ�����ƿ���ռ������������Ҫ�ɷ���__________��
��4�����Թ�a���ռ�����Һ����ʪ�����ɫʯ����ֽ���飬��ֽ�Ժ�ɫ���Ʋ�ʵ���з�Ӧ��������һ���л�������ø�����Ϊ_______����ṹ��ʽ����Ҫ��ȥ�����ʣ������ڻ��Һ�м���_______������ĸ��ţ���Ȼ����ͨ��_______����������ƣ����ɳ�ȥ��
a���Ȼ�����Һ b���� c��̼��������Һ d�����Ȼ�̼
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com