
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na 2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D.NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| A、Cl2(HCl) |
| B、NaHCO3溶液(Na 2CO3) |
| C、CO2(HCl) |
| D、NO(NO2) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、由水电离产生的c(OH-)=10-12mol?L-1 | ||
| B、向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) | ||
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和等物质的量的HCl | ||
D、用水稀释时,溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
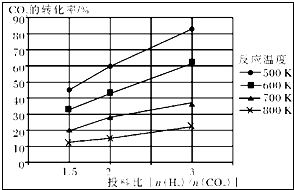
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| B | 2P轨道上有二个孤电子 |
| C | 与B同主族 |
| D | 前四周期中金属性最强的元素 |
| E | 前四周期中原子核外孤电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
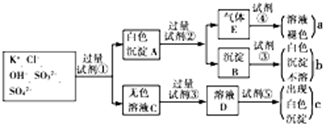
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①② |
| C、只有③ | D、全部错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:
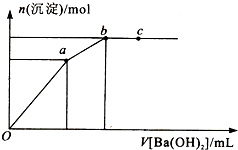 向100mL 0.1mol?L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )| A、a点时溶液中所含主要溶质为(NH4)2SO4 |
| B、a→b段发生反应的离子方程式是:SO42-+Ba2+=BaSO4↓ |
| C、b点为最大沉淀量,对应的纵坐标值为0.2 |
| D、c点加入Ba(OH)2溶液的体积为200 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28 g C2H4中含有2 NA个碳原子 |
| B、常温常压下,22.4L氦气含有的原子数为2NA |
| C、1mol S在足量O2中燃烧,转移的电子数为6 NA |
| D、0.1 mol?L-1的碳酸氢钠溶液中含钠离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、由重晶石制备高纯BaSO4只需经过两步化学反应 | ||||
B、反应C(g)+CO2(g)
| ||||
| C、实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温 | ||||
| D、以BaS作为沉淀剂,用于铅和汞沉淀的转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com