
”¾ĢāÄæ”æ1£¬2©¶žäåŅŅĶéæÉ×÷ĘūÓĶæ¹±¬¼ĮµÄĢķ¼Ó¼Į£¬³£ĪĀĻĀĖüŹĒĪŽÉ«ŅŗĢ壬·Šµć131.4”ę£¬ČŪµć9.79”ę£¬²»ČÜÓŚĖ®£¬Ņ×ČÜÓŚ“¼”¢ĆŃ”¢±ūĶŖµČÓŠ»śČܼĮ£®ŌŚŹµŃéÖŠæÉŅŌÓĆČēĶ¼ĖłŹ¾×°ÖĆÖʱø1£¬2©¶žäåŅŅĶ飮ĘäÖŠ·ÖŅŗĀ©¶·ŗĶÉÕĘæa֊װӊŅŅ“¼ŗĶÅØĮņĖįµÄ»ģŗĻŅŗ£¬ŹŌ¹Üd֊װӊÅØäå£Ø±ķĆęø²øĒÉŁĮæĖ®£©£®ĒėĢīŠ“ĻĀĮŠæÕ°×£ŗ 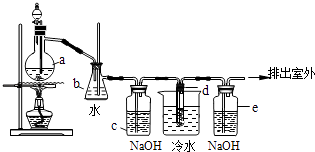
£Ø1£©ÉÕĘæaŅŖĒóĪĀ¶ČŃøĖŁÉżøßµ½170”ę·¢Éś·“Ó¦£¬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£»øĆ·“Ó¦ĄąŠĶĪŖ £®
£Ø2£©Š“³öÖʱø1£¬2©¶žäåŅŅĶéµÄ»Æѧ·½³ĢŹ½ £®
£Ø3£©°²Č«ĘæbæÉŅŌ·ĄÖ¹µ¹Īü£¬²¢æÉŅŌ¼ģ²éŹµŃé½ųŠŠŹ±ŹŌ¹ÜdŹĒ·ń·¢Éś¶ĀČū£®ĒėŠ“³ö·¢Éś¶ĀČūŹ±ĘæbÖŠµÄĻÖĻó £®
£Ø4£©ČŻĘ÷cÖŠNaOHČÜŅŗµÄ×÷ÓĆŹĒ£»e×°ÖĆÄŚNaOHČÜŅŗµÄ×÷ÓĆŹĒ £®
£Ø5£©Ä³Ń§Éś×ö“ĖŹµŃ鏱£¬Ź¹ÓĆŅ»¶ØĮæµÄŅŗä壬µ±äåČ«²æĶŹÉ«Ź±£¬ĖłĻūŗÄŅŅ“¼ŗĶÅØĮņĖį»ģŗĻŅŗµÄĮ棬±ČÕż³£ĒéæöĻĀ³¬³öŠķ¶ą£¬Čē¹ū×°ÖƵÄĘųĆÜŠŌƻӊĪŹĢā£¬ŹŌ·ÖĪöĘäæÉÄܵÄŌŅņ£ØÖĮÉŁ2µć£©”¢ £®
”¾“š°ø”æ
£Ø1£©CH3CH2OH ![]() CH2=CH2”ü+H2O£»ĻūČ„·“Ó¦
CH2=CH2”ü+H2O£»ĻūČ„·“Ó¦
£Ø2£©CH2=CH2+Br2”śCH2BrCH2Br
£Ø3£©bÖŠĖ®Ćę»įĻĀ½µ,²£Į§¹ÜÖŠµÄĖ®Öł»įÉĻÉż,ÉõÖĮŅē³ö
£Ø4£©ĪüŹÕŅŅĻ©ĘųĢåÖŠŗ¬ÓŠµÄCO2”¢SO2µČĖįŠŌĘų£»ĪüŹÕHBrŗĶBr2µČĘųĢå,·ĄÖ¹“óĘųĪŪČ¾
£Ø5£©¢ŁŅŅĻ©Į÷ĖŁ¹żæģ,Ī“ĶźČ«·¢Éś¼Ó³É·“Ó¦£»¢ŚŹµŃé¹ż³ĢÖŠ,ŅŅĻ©ŗĶÅØĮņĖįµÄ»ģŗĻŅŗƻӊŃøĖŁ“ļµ½170”ę,·¢Éśø±·“Ӧɜ³ÉŅŅĆŃ
”¾½āĪö”æ½ā£ŗ£Ø1£©ŅŅ“¼ŌŚ170”ꏱ·¢ÉśĻūČ„·“Ӧɜ³ÉŅŅĻ©£¬ĪĀ¶Č±ŲŠėŹĒ170”ę£¬·“Ó¦·½³ĢŹ½£ŗCH3CH2OH ![]() CH2=CH2”ü+H2O£¬
CH2=CH2”ü+H2O£¬
¹Ź“š°øĪŖ£ŗCH3CH2OH ![]() CH2=CH2”ü+H2O£»ĻūČ„·“Ó¦£»£Ø2£©ŅŅĻ©ÓėŅŗäå·¢Éś¼Ó³É·“Ӧɜ³É1£¬2©¶žäåŅŅĶé»Æѧ·½³ĢŹ½ĪŖ£ŗCH2=CH2+Br2”śCH2BrCH2Br£»
CH2=CH2”ü+H2O£»ĻūČ„·“Ó¦£»£Ø2£©ŅŅĻ©ÓėŅŗäå·¢Éś¼Ó³É·“Ӧɜ³É1£¬2©¶žäåŅŅĶé»Æѧ·½³ĢŹ½ĪŖ£ŗCH2=CH2+Br2”śCH2BrCH2Br£»
¹Ź“š°øĪŖ£ŗCH2=CH2+Br2”śCH2BrCH2Br£»£Ø3£©ŹŌ¹Üd·¢Éś¶ĀČūŹ±£¬bÖŠŃ¹Ēæ²»¶ĻŌö“󣬻įµ¼ÖĀbÖŠĖ®ĆęĻĀ½µ£¬²£Į§¹ÜÖŠµÄĖ®ÖłÉĻÉż£¬ÉõÖĮŅē³ö£¬
¹Ź“š°øĪŖ£ŗbÖŠĖ®Ćę»įĻĀ½µ£¬²£Į§¹ÜÖŠµÄĖ®Öł»įÉĻÉż£¬ÉõÖĮŅē³ö£»£Ø4£©×°ÖĆcÖŠĒāŃõ»ÆÄĘČÜŅŗ×÷ÓĆŹĒĪüŹÕŅŅĻ©ĘųĢåÖŠŗ¬ÓŠµÄCO2”¢SO2µČĖįŠŌĘų£¬øĆ·“Ó¦ÖŠŹ£ÓąµÄäå»ÆĒā¼°·“Ó¦ø±²śĪļäåµ„ÖŹµČÓŠ¶¾£¬»įĪŪČ¾“óĘų£¬Ó¦øĆ½ųŠŠĪ²ĘųĪüŹÕ£¬ĖłŅŌ×°ÖĆeÖŠĒāŃõ»ÆÄĘČÜŅŗµÄ×÷ÓĆŹĒĪüŹÕHBrŗĶBr2µČĘųĢ壬·ĄÖ¹“óĘųĪŪČ¾£¬
¹Ź“š°øĪŖ£ŗĪüŹÕŅŅĻ©ĘųĢåÖŠŗ¬ÓŠµÄCO2”¢SO2µČĖįŠŌĘų£»ĪüŹÕHBrŗĶBr2µČĘųĢ壬·ĄÖ¹“óĘųĪŪČ¾£»£Ø5£©µ±äåČ«²æĶŹÉ«Ź±£¬ĖłĻūŗÄŅŅ“¼ŗĶÅØĮņĖį»ģŗĻŅŗµÄĮ棬±ČÕż³£ĒéæöĻĀ³¬¹żŠķ¶ąµÄŌŅņæÉÄÜŹĒŅŅĻ©·¢Éś£Ø»ņĶعżŅŗä壩ĖŁ¶Č¹żæģ£¬µ¼ÖĀ“ó²æ·ÖŅŅĻ©Ć»ÓŠŗĶäå·¢Éś·“Ó¦£»“ĖĶāŹµŃé¹ż³ĢÖŠ£¬ŅŅ“¼ŗĶÅØĮņĖįµÄ»ģŗĻŅŗƻӊŃøĖŁ“ļµ½170”ę»įµ¼ÖĀø±·“Ó¦µÄ·¢ÉśŗĶø±²śĪļµÄÉś³É£¬
¹Ź“š°øĪŖ£ŗ¢ŁŅŅĻ©Į÷ĖŁ¹żæģ£¬Ī“ĶźČ«·¢Éś¼Ó³É·“Ó¦”¢¢ŚŹµŃé¹ż³ĢÖŠ£¬ŅŅĻ©ŗĶÅØĮņĖįµÄ»ģŗĻŅŗƻӊŃøĖŁ“ļµ½170”ę£¬·¢Éśø±·“Ӧɜ³ÉŅŅĆŃ£»
£Ø1£©ŅŅ“¼ŌŚÅØĮņĖį×ö“߻ƼĮ”¢ĶŃĖ®¼ĮĢõ¼žĻĀ·¢ÉśĻūČ„·“Ӧɜ³ÉŅŅĻ©£¬±ŲŠė×¢Ņā·“Ó¦ĪĀ¶Č£»£Ø2£©ŅŅĻ©ÓėŅŗäå·¢Éś¼Ó³É·“Ӧɜ³É1£¬2©¶žäåŅŅĶ飻£Ø3£©ŅĄ¾Żµ±d¶ĀČūŹ±£¬ĘųĢå²»³©ĶØ£¬ŌņŌŚbÖŠĘųĢå²śÉśµÄŃ¹Ē潫Ė®Ń¹ČėÖ±²£Į§¹ÜÖŠ£¬ÉõÖĮŅē³ö²£Į§¹Ü£»£Ø4£©CÖŠµÄĒāŃõ»ÆÄĘæÉŅŌŗĶÖĘČ”ŅŅĻ©ÖŠ²śÉśµÄŌÓÖŹĘųĢ嶞Ńõ»ÆĢ¼ŗĶ¶žŃõ»ÆĮņ·¢Éś·“Ó¦£»·“Ó¦Ź£ÓąµÄäå»ÆĒā”¢äåµČÓŠ¶¾£¬Äܹ»ĪŪČ¾“óĘų£¬ŠčŅŖ½ųŠŠĪ²ĘųĪüŹÕ£¬ÓĆeĪüŹÕ£»£Ø5£©øł¾ŻŅŅĻ©Óėäå·“Ó¦µÄĄūÓĆĀŹ¼õÉŁµÄæÉÄÜŌŅņ½ųŠŠ½ā“š£»


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ£Ø £©
A. Ļ”ĮņĖįŗĶĒāŃõ»Æ±µČÜŅŗ·“Ó¦£ŗ H++SO42-+Ba2++OH-=BaSO4”ż+H2O
B. ĀČĘųÓėĖ®·“Ó¦£ŗCl2£«H2O![]() 2H£«£«Cl££«ClO-
2H£«£«Cl££«ClO-
C. ĻņNaAlO2ČÜŅŗÖŠĶØČė¹żĮæCO2ÖĘAl(OH)3£ŗ2AlO2-+CO2+3H2O=2Al(OH)3”ż+CO32-
D. NaOHČÜŅŗÖŠĶØČė¹żĮæCO2£ŗOH££«CO2 = HCO3£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĖłŹ¾ŹĒ![]() µÄĮ½øöŠŌÖŹŹµŃ飬ĻĀĮŠÓŠ¹ŲĖµ·ØÖŠÕżČ·µÄŹĒ
µÄĮ½øöŠŌÖŹŹµŃ飬ĻĀĮŠÓŠ¹ŲĖµ·ØÖŠÕżČ·µÄŹĒ![]()
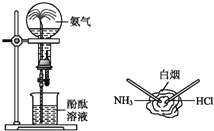
A. Į½øöŹµŃé¾ł±ķĻÖĮĖ![]() Ņ×ČÜÓŚĖ®
Ņ×ČÜÓŚĖ®
B. Į½øöŹµŃé¾ł±ķĻÖĮĖ![]() Ņ×»Ó·¢
Ņ×»Ó·¢
C. Į½øöŹµŃé¾ł±ķĻÖĮĖ![]() ŹĒ¼īŠŌĘųĢå
ŹĒ¼īŠŌĘųĢå
D. Į½øöŹµŃé¾ł±ķĻÖĮĖ![]() ŹĒ»¹ŌŠŌĘųĢå
ŹĒ»¹ŌŠŌĘųĢå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×ĖįĻćŅ¶õ„ŹĒŅ»ÖÖŹ³Ę·ĻćĮĻ£®æÉŅŌÓÉĻćŅ¶“¼Óė¼×Ėį·¢Éśõ„»Æ·“Ó¦ÖĘµĆ£®ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø””””£© 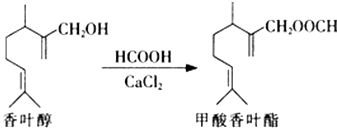
A.ĻćŅ¶“¼µÄ·Ö×ÓŹ½ĪŖC11H18O
B.ĻćŅ¶“¼ŌŚÅØĮņĖį”¢¼ÓČČĢõ¼žĻĀæÉ·¢ÉśĻūČ„·“Ó¦
C.1 mol¼×ĖįĻćŅ¶õ„æÉŅŌÓė2 molH2·¢Éś¼Ó³É·“Ó¦
D.¼×ĖįĻćŅ¶õ„·Ö×ÓÖŠĖłÓŠĢ¼Ō×Ó¾łæÉÄܹ²Ę½Ćę
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĢśµÄ”°Ńõ»ÆĪļ”±ŃłĘ·£¬ÓĆ5mol/LŃĪĖį0.14LĒ”ŗĆĶźČ«·“Ó¦£¬ĖłµĆČÜŅŗ»¹ÄÜĪüŹÕ±ź×¼×“æöĻĀ2.24LĀČĘų£¬Ź¹ĘäÖŠFe2+Č«²æ×Ŗ»ÆĪŖFe3+£®øĆѳʷæÉÄܵĻÆѧŹ½ŹĒ£Ø””””£©
A. Fe5O6 B. Fe3O4 C. Fe6O7 D. Fe5O7
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±ūĻ©Ėį£ØCH2= CH”ŖCOOH£©ÄÜ·¢ÉśµÄ·“Ó¦æÉÄÜÓŠ£Ø £©
¢Ł ¼Ó³É·“Ó¦ ¢Ś Ė®½ā·“Ó¦ ¢Ū õ„»Æ·“Ó¦ ¢Ü ÖŠŗĶ·“Ó¦ ¢Ż Ńõ»Æ·“Ó¦
A.Ö»ÓŠ¢Ł¢ŪB.Ö»ÓŠ¢Ł¢Ū¢ÜC.Ö»ÓŠ¢Ł¢Ū¢Ü¢ŻD.¢Ł¢Ś¢Ū¢Ü¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖ®ÄąŹĒÖŲŅŖµÄ½ØÖž²ÄĮĻ£®Ė®ÄąŹģĮĻµÄÖ÷ŅŖ³É·ÖĪŖ![]() ”¢
”¢![]() £¬²¢ŗ¬ÓŠŅ»¶ØĮæµÄĢś”¢ĀĮŗĶĆ¾µČ½šŹōµÄŃõ»ÆĪļ£®ŹµŃéŹŅ²ā¶ØĖ®ÄąŃłĘ·ÖŠøĘŗ¬ĮæµÄ¹ż³ĢČēĶ¼ĖłŹ¾£ŗ
£¬²¢ŗ¬ÓŠŅ»¶ØĮæµÄĢś”¢ĀĮŗĶĆ¾µČ½šŹōµÄŃõ»ÆĪļ£®ŹµŃéŹŅ²ā¶ØĖ®ÄąŃłĘ·ÖŠøĘŗ¬ĮæµÄ¹ż³ĢČēĶ¼ĖłŹ¾£ŗ
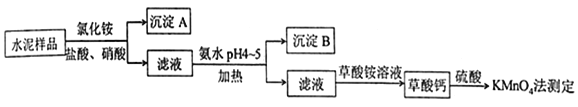
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŌŚ·Ö½āĖ®ÄąŃłĘ·¹ż³ĢÖŠ£¬ŅŌŃĪĖįĪŖČܼĮ£¬ĀČ»Æļ§ĪŖÖśČܼĮ£¬»¹Šč¼ÓČė¼øµĪĻõĖį£®¼ÓČėĻõĖįµÄÄæµÄŹĒ________£¬»¹æÉŹ¹ÓĆ________“śĢęĻõĖį£®
£Ø2£©³Įµķ![]() µÄÖ÷ŅŖ³É·ÖŹĒ________£¬Ęä²»ČÜÓŚĒæĖįµ«æÉÓėŅ»ÖÖČõĖį·“Ó¦£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_____________________________________________
µÄÖ÷ŅŖ³É·ÖŹĒ________£¬Ęä²»ČÜÓŚĒæĖįµ«æÉÓėŅ»ÖÖČõĖį·“Ó¦£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_____________________________________________
£Ø3£©¼Ó°±Ė®¹ż³ĢÖŠ¼ÓČȵÄÄæµÄŹĒ__________________£®³Įµķ![]() µÄÖ÷ŅŖ³É·ÖĪŖ________”¢________£ØĢī»ÆѧŹ½£©£®
µÄÖ÷ŅŖ³É·ÖĪŖ________”¢________£ØĢī»ÆѧŹ½£©£®
£Ø4£©²ŻĖįøĘ³Įµķ¾Ļ”![]() “¦Ąķŗó£¬ÓĆ
“¦Ąķŗó£¬ÓĆ![]() ±ź×¼ČÜŅŗµĪ¶Ø£¬Ķعż²ā¶Ø²ŻĖįµÄĮææɼä½Ó»ńÖŖøʵÄŗ¬Į棬µĪ¶Ø·“Ó¦ĪŖ£ŗ
±ź×¼ČÜŅŗµĪ¶Ø£¬Ķعż²ā¶Ø²ŻĖįµÄĮææɼä½Ó»ńÖŖøʵÄŗ¬Į棬µĪ¶Ø·“Ó¦ĪŖ£ŗ ![]() £®ŹµŃéÖŠ³ĘČ”
£®ŹµŃéÖŠ³ĘČ”![]() Ė®ÄąŃłĘ·£¬µĪ¶ØŹ±ĻūŗÄĮĖ
Ė®ÄąŃłĘ·£¬µĪ¶ØŹ±ĻūŗÄĮĖ![]() µÄ
µÄ![]() ČÜŅŗ
ČÜŅŗ![]() £¬ŌņøĆĖ®ÄąŃłĘ·ÖŠøʵÄÖŹĮæ·ÖŹżĪŖ________£®
£¬ŌņøĆĖ®ÄąŃłĘ·ÖŠøʵÄÖŹĮæ·ÖŹżĪŖ________£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŅ¹śŹĒŹĄ½ēÉĻ×ī“óµÄĪŁ“¢²Ų¹ś”£½šŹōĪŁæÉÓĆÓŚÖĘŌģµĘĖ攢³¬Ó²Ä£¾ßŗĶ¹āѧŅĒĘ÷”£ŌŚ¹¤ŅµÉĻ³£²ÉÓĆøßĪĀ»¹ŌWO3·ØÖĘČ”½šŹōĪŁ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©°×ĪŁæó(Ö÷ŅŖ³É·ÖŹĒCaWO4)ÓėŃĪĖį·“Ӧɜ³É³Įµķ£¬×ĘÉÕ³Įµķ¼“æɵƵ½WO3£¬ÉĻŹöĮ½²½·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________________”¢__________________”£
£Ø2£©T”ꏱ£¬WO3¾ČēĻĀµÄĖIJ½·“Ӧɜ³ÉW”£ĆæŅ»²½·“Ó¦µÄģŹ±äŗĶĘ½ŗā³£ŹżČēĻĀ£ŗ WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) ”÷H1 K1
WO2.9(s)+0.1H2O(g) ”÷H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) ”÷H2 K2
WO2.72(s)+0.18H2O(g) ”÷H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) ”÷H3 K3
WO2(s)+0.72H2O(g) ”÷H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) ”÷H4 K4
W(s)+2H2O(g) ”÷H4 K4
ŌņøĆĪĀ¶ČĻĀ£¬WO3(s)+3H2(g)![]() W(s)+3H2O(g) ”÷H=_________£¬K=__________”£
W(s)+3H2O(g) ”÷H=_________£¬K=__________”£
£Ø3£©T1”ꏱ£¬½«Ņ»¶ØÖŹĮæWO3ŗĶ8.0gH2ÖĆÓŚ2LĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦£ŗ WO3(s)+3H2(g)![]() W(s)+3H2O(g)£¬»ģŗĻĘųĢåø÷×é·ÖĪļÖŹµÄĮæÖ®±ČĖꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ
W(s)+3H2O(g)£¬»ģŗĻĘųĢåø÷×é·ÖĪļÖŹµÄĮæÖ®±ČĖꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ

¢ŁT1”ꏱ£¬H2µÄĘ½ŗā×Ŗ»ÆĀŹa=_________%£¬·“Ó¦Ę½ŗā³£ŹżK=__________”£
¢ŚČōŌŚ4minŹ±½µµĶ²¢Ī¬³ÖĪĀ¶ČĪŖT2”ę£¬ŌņøĆ·“Ó¦µÄ”÷H_______0£¬ČōŌŚ8minŹ±ĖõŠ”ČŻĘ÷ČŻ»ż£¬Ōņ![]() _________1.3”£(Ģī”°>”±”° <”±»ņ”°=”±)
_________1.3”£(Ģī”°>”±”° <”±»ņ”°=”±)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com