
【题目】工业上以氧化铝为原料可制得一些物质。
(1)碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)==4Al(g)+3O2(g) △H1=+3351KJmol﹣1
2C(s)+O2(g)==2CO(g) △H2=-221KJmol﹣1
2Al(g)+N2(g)==2AlN(s) △H3=-318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是________________________________________________,
(2)电解法可制取铝。以石墨作电极电解熔融 Al2O3(加入Na3AlF6为助熔剂)
①电解时铝在_____________产生(填阴极或阳极)
②电解过程中作阳极的石墨易消耗,原因是________________________。
(3)二氧化碳甲烷化再利用
①已知反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
②据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_________________。
【答案】3C(s) + Al2O3(s)+N2(g)=2AlN(s)+3CO(g) △H = +1026KJ/mol阴极和阳极产生的氧气反应K=c (CH4)c2( H2O)/c( CO2)c4(H2) CO2+6H2O+8e﹣═ CH4+8OH﹣
【解析】
(1)盖斯定律计算,(①+②×3+③×2)×1/2得到碳热还原Al2O3合成AlN的总热化学方程式。
(2)由电解原理可知,阴极上铝离子得到电子,阳极上是氧离子失电子发生氧化反应;
②电解过程中生成的氧气全部与石墨电极反应生成CO和CO2气体.因此,需要不断补充石墨电极;
(3)①依方程式结合平衡常数的概念写出平衡常数的表达式。
②CO2可以在碱性水溶液中电解生成甲烷,二氧化碳得电子生成甲烷。
(1)已知:①2Al2O3(s)==4Al(g)+3O2(g) △H1=+3351KJmol﹣1
②2C(s)+O2(g)==2CO(g) △H2=-221KJmol﹣1
③2Al(g)+N2(g)==2AlN(s) △H3=-318KJmol﹣1
盖斯定律计算,(①+②×3+③×2)×1/2得到碳热还原Al2O3合成AlN的总热化学方程式,3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=+1026KJ·mol-1·L-1。
(2)①由电解原理可知,阴极上铝离子得到电子生成铝,故铝在阴极上生成;阳极上是氧离子失电子发生氧化反应,电解时阳极的电极反应式为:2O2--4e-=O2↑;
②电解过程中作阳极的石墨易消耗,原因是石墨电极被阳极上产生的氧气氧化。
(3)①依方程式结合平衡常数的概念写出平衡常数的表达式:K=c (CH4)c2( H2O)/c( CO2)c4(H2) ;
②CO2可以在碱性水溶液中电解生成甲烷,二氧化碳得电子生成甲烷,电极反应式是CO2+6H2O+8e﹣═ CH4+8OH﹣。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,化学式可表示为[Fea(OH)b(SO4)c]m,取其与足量盐酸反应,所得溶液平均分为两份,一份溶液加入足量的BaCl2溶液,得到沉淀4.66 g。另一份溶液,加入足量的NaOH溶液后过滤,对滤出固体洗涤,后灼烧得到红棕色固体质量为1.6 g,该聚合硫酸铁样品中a∶b的比值是
A. 1∶1B. 2∶1C. 3∶1D. 2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入2mL盐酸于试管中。下列对烧杯中的实验现象的描述及原因说明中正确的是()

A. 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱和石灰水温度升高,溶质析出
B. 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出
C. 烧杯中没有任何现象,原因是试管中的反应与烧杯中饱和石灰水没有关系
D. 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1 盐酸与 50 mL 0.55 mol·L -1 NaOH 溶液在图示的装置中进行中和反应。通过测定反应过程中的热量可计算中和热。回答下列问题:
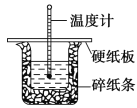
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________________
(2)烧杯间填满碎纸条的作用是______________________ 。
(3)从下列选项中选出倒入NaOH溶液的正确操作________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)大烧杯上如不盖硬纸板,求得的中和热数值将______ (填“偏 大”、“偏小”或“无影响”)。
(5)实验中改用60 mL 0.50 mol·L-1 盐酸跟 50 mL 0.55 mol·L-1 NaOH 溶液进行反应,与上述实验相比,所放出的热量________(填“变大”、“变小”或“不变”),所求中和热________(填“变大”、“变小”或“不变”)
(6)用50 mL 0.50 mol·L-1 CH3COOH 溶液(已知CH3COOH 电离时吸热)进行上述实验,测得的中和热的数值会________。(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积固定的密闭容器中充入CH4、CO2 发生此反应![]() ,下列选项可说明上述反应达到平衡状态的是( )。
,下列选项可说明上述反应达到平衡状态的是( )。
A. 混合气体的密度不再发生变化B. 混合气体的平均相对分子质量不再发生变化
C. 混合气体的总质量不再发生变化D. 相同时间内每断开2mol C=O键,同时断开1mol H-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制备氯气并进行一系列相关实验的装置(有些夹持设备已略)。
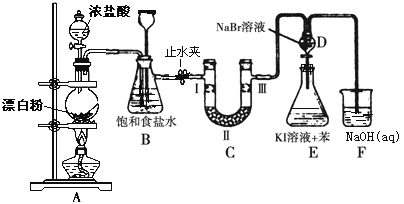
(1)写出A装置生成氯气的化学反应方程式____________________________。
(2)装置B除及吸收HCl外还有两个作用, 请写出: _________________,________________。
(3)装置C的实验目的是验证氯气是否具有漂白性, 为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
编号 | 1 | 2 | 3 | 4 |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 硅胶 | 浓硫酸 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_______________________该现象_______(填“能”或“不能”)说明溴的非金属性强于碘,原因是____________________。
(5)有人提出,装置F中可改用足量的Na2S2O3溶液吸收余氯,试写出相应的离子方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。

A. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. 在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D. 从第③步到第⑤步的目的是为了提纯Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,反应X(g)![]() 4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是
4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是

A. 2 min内,X的平均反应速率为0.25 mol·L-1·min-1
B. 第t min时,该反应达到平衡状态
C. 第5 min后,X的生成速率与Z的生成速率相等且保持不变
D. 5 min内,反应放出的热量为1.6Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是
A. 反应①的平衡常数K1=![]()
B. 反应③的平衡常数K=![]()
C. 对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
D. 对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com