
科目:高中化学 来源: 题型:阅读理解
| 气体 | SO2 | N2 | O2 |
| 物质的量 | 10 | 58 | 6 |
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 32V |
| 22.4W |
| 22.4V |
| 32W |
| 3(W-m) |
| W |
| 8(W-m) |
| 5W |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源:福建省泉州市德化县2010届高三上学期期末考试化学试卷 题型:022
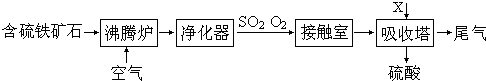
以黄铁矿为原料生产硫酸的工艺流程图如下:
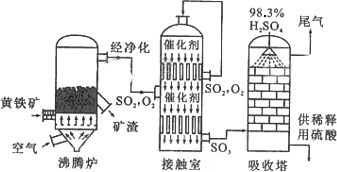
(1)请写出沸腾炉中黄铁矿燃烧的化学方程式:________________.
(2)接触室中2SO2(g)
+O2(g)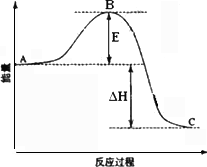
①依据工艺流程图判断下列说法正确的是(选填序号字母)________.
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
②反应达到平衡时,平衡常数表达式K=________,升高温度,K值________(填“增大”、“减小”或“不变”);图中△H=________KJ·mol-1.
③图中C点表示________,E的大小对该反应的反应热________(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点________(填“升高”或“降低”).
④如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=________mol·L-1·min-1;
⑤已知单质硫的燃烧热为-296 KJ·mol-1,计算由S(s)生成3 mol SO3(g)的△H=________.
(3)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是________________.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2Fe2O3+8SO2.
2Fe2O3+8SO2.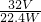 B.
B.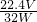 C.
C.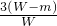 D.
D.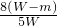
 ,则SO2的转化率为______.
,则SO2的转化率为______.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
| 32V |
| 22.4W |
| 22.4V |
| 32W |
| 3(W-m) |
| W |
| 8(W-m) |
| 5W |
| 1 |
| 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com