
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下: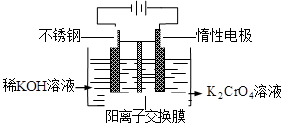
下列说法不正确的是
| A.在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2 +2H+ +2H+  +H2O向右移动 +H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑ 2K2Cr2O7+4KOH+2H2↑+O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-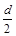 |
D
解析试题分析:电解池中阴极得到电子,所以根据装置图可知,A正确;阳极失去电子,则溶液中的OH-失去电子,从而破坏阳极周围水的电离平衡,所以溶液显酸性,因此B正确;根据阳极和阴极的电极反应式可知,选项C正确;因为使用了阳离子膜,所以K离子可以随意通过,而膜两侧的溶液一定要分别保持电中性,所以由方程式系数可知:
4 K2CrO4~~ 2 K2Cr2O7
起始量(mol) 1 0
转化量(mol) 4x 2x
平衡量(mol) 1-4x 2x
阳极区的钾离子:2×(1-4x)+2×2x=2-4x,铬:(1-4x)+4x=1
由题目已知,可得:K/Cr=(2-4x)/1=d,即(2-4x)/1=d
而根据转化率定义:α=4x/1,代入上面式子2-α=d,即转化率为2-d。所以答案选D。
考点:电解原理
点评:电解中最关键的是准确判断出电极上离子的放电顺序。在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。


科目:高中化学 来源:2012-2013学年安徽省“江南十校”高三第一次模拟考试化学试卷(解析版) 题型:填空题
某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:

已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是 。(写化学式)
(2)写出第③步反应的离子方程式 。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有 。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:

电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比 为d,则此时的铬酸钾的转化率为
。
为d,则此时的铬酸钾的转化率为
。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省九江市高三入学考试化学试卷(解析版) 题型:选择题
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
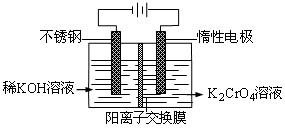
A.在阴极区,发生的电极反应为:2H2O+2e-==2OH―+H2↑
B.在阳极区,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡 向右移动
向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+2O2↑
2K2Cr2O7+4KOH+2H2↑+2O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=d/2
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:选择题
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:

下列说法不正确的是
A.在阴极室,发生的电极反应为:2H2O+2e—=2OH—+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡
2CrO42—+2H+ Cr2O72—+H2O向右移动
Cr2O72—+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr )为d,则此时铬酸钾的转化率为1-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com