
”¾ĢāÄæ”æ£Ø¢ń£©”¢ČēĶ¼ĪŖŅ»”°ĢśĮ“”±Ķ¼°ø£¬Š”Ć÷ŌŚĶ¼°øÉĻ·Ö±šŠ“ĮĖH2”¢CO2”¢Na2O”¢NaCl”¢FeCl3ĪåÖÖĪļÖŹ£¬Ķ¼ÖŠĻąĮ¬µÄĮ½ÖÖĪļÖŹ¾łæɹéŹōĪŖŅ»Ąą£¬Ļą½»²æ·ÖA”¢B”¢C”¢DĪŖĘäĻąÓ¦µÄ·ÖĄąŅĄ¾Ż“śŗÅ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
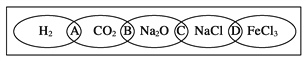
£Ø1£©Ēė½«·ÖĄąŅĄ¾Ż“śŗÅĢīČėĻąÓ¦µÄĄØŗÅÄŚ£ŗ
£Ø______£©Į½ÖÖĪļÖŹ¶¼²»ŹĒµē½āÖŹ
£Ø______£©Į½ÖÖĪļÖŹ¶¼ŹĒŃĪ
£Ø2£©ÓĆ½ą¾»µÄÉÕ±Č”ÉŁĮæÕōĮóĖ®£¬ÓĆ¾Ę¾«µĘ¼ÓČČÖĮ·ŠĢŚ£¬ĻņÉÕ±ÖŠÖšµĪ¼ÓČė±„ŗĶµÄĶ¼ÖŠÄ³ÖÖĪļÖŹMµÄČÜŅŗ¼ÓČČÖĮ³ŹŗģŗÖÉ«”£
¢ŁĪļÖŹMµÄ»ÆѧŹ½ĪŖ________________”£
¢ŚÖ¤Ć÷ÓŠŗģŗÖÉ«½ŗĢåÉś³ÉµÄŹµŃé²Ł×÷ŹĒ________________________________________”£
£Ø¢ņ£©·“Ó¦£ŗA£®2F2£«2H2O£½4HF£«O2”ü£» B£®2Na£«2H2O£½2NaOH£«H2”ü£»
C£®CaO£«H2O£½Ca(OH)2£» D£®2H2O£½2H2”ü£«O2”ü”£
ĘäÖŠĖ®ŹĒŃõ»Æ¼ĮµÄŹĒ______£¬Ė®ŹĒ»¹Ō¼ĮµÄŹĒ________”££ØĢīŠņŗÅ£©
(¢ó)·“Ó¦£ŗ3Cu + 8HNO3 = 3Cu(NO3)2+2NO”ü+4H2O,»¹Ō¼ĮÓėŃõ»Æ¼ĮµÄĪļÖŹµÄĮæÖ®±Č£ŗ_______£¬µ±ÓŠ0.6molµē×Ó×ŖŅĘŹ±”£Éś³ÉµÄNOŌŚ±ź×¼×“æöµÄĢå»żĪŖ________L”£
”¾“š°ø”æA D FeCl3 ÓĆŅ»Źų¹āÕÕÉäÉÕ±ÖŠµÄĪļÖŹ£¬ČōÄܲśÉś¶”“ļ¶ūŠ§Ó¦£¬ŌņÖ¤Ć÷Éś³ÉĮĖFe(OH)3½ŗĢå B A 3:2 4.48
”¾½āĪö”æ
£Ø¢ń£©”¢£Ø1£©ĒāĘųŹōÓŚµ„ÖŹ£¬µē½āÖŹ±ŲŠėŹĒ»ÆŗĻĪļ£¬²»ŹōÓŚµē½āÖŹµÄ·¶³ė£¬¶žŃõ»ÆĢ¼µÄĖ®ČÜŅŗÄܵ¼µē£¬ŹĒÉś³ÉµÄĢ¼Ėįµ¼µē£¬¶žÕß²»ŹōÓŚµē½āÖŹ£¬ŗ¬ÓŠÄĘŌŖĖŲµÄ»ÆŗĻĪļŹĒŃõ»ÆÄĘŗĶĀČ»ÆÄĘ£¬¶žŃõ»ÆĢ¼ŗĶŃõ»ÆÄĘÖŠÓŠĮ½ÖÖŌŖĖŲ×é³É£¬Ņ»ÖÖŹĒŃõŌŖĖŲ£¬ŹōÓŚŃõ»ÆĪļ£¬ĀČ»ÆÄĘŗĶĀČ»ÆĢśŹĒÄܵēĄė³öĖįøłŅõĄė×ÓŗĶ½šŹōŃōĄė×ӵĻÆŗĻĪļ£¬ŹōÓŚŃĪĄą£¬“š°øŃ”A”¢D£»
£Ø2£©¢ŁÓĆ½ą¾»µÄÉÕ±Č”ÉŁĮæÕōĮóĖ®£¬ÓĆ¾Ę¾«µĘ¼ÓČČÖĮ·ŠĢŚ£¬ĻņÉÕ±ÖŠÖšµĪ¼ÓČėĀČ»ÆĢśµÄ±„ŗĶČÜŅŗ£¬¼ĢŠųÖó·ŠæÉÖʵĆŅ»ÖÖŗģŗÖÉ«ĒāŃõ»ÆĢś½ŗĢ壻
¢Ś½ŗĢåæÉŅŌ²śÉś¶”“ļ¶ūŠ§Ó¦£¬Ņņ“ĖÖ¤Ć÷ÓŠŗģŗÖÉ«½ŗĢåÉś³ÉµÄŹµŃé²Ł×÷ŹĒ£ŗÓĆŅ»Źų¹āÕÕÉäÉÕ±ÖŠµÄĪļÖŹ£¬ČōÄܲśÉś¶”“ļ¶ūŠ§Ó¦£¬ŌņÖ¤Ć÷Éś³ÉĮĖFe(OH)3½ŗĢ唣
£Ø¢ņ£©”¢·“Ó¦2F2£«2H2O£½4HF£«O2”üÖŠŃõŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬Ė®ŹĒ»¹Ō¼Į£»·“Ó¦2Na£«2H2O£½2NaOH£«H2”üÖŠĒāŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬Ė®ŹĒŃõ»Æ¼Į£»·“Ó¦CaO£«H2O£½Ca(OH)2ÖŠŌŖĖŲµÄ»ÆŗĻ¼Ū¾ł²»±ä»Æ£¬ŹĒ·ĒŃõ»Æ»¹Ō·“Ó¦£»·“Ó¦ÖŠ2H2O£½2H2”ü£«O2”üĒāŌŖĖŲŗĶŃõŌŖĖŲµÄ»ÆŗĻ¼Ū¾ł·¢Éś±ä»Æ£¬ŹĒĖ®µÄ·Ö½ā·“Ó¦£¬Ė®¼ČŹĒŃõ»Æ¼Į£¬Ņ²ŹĒ»¹Ō¼Į”£
(¢ó)”¢·“Ó¦3Cu + 8HNO3£½3Cu(NO3)2+2NO”ü+4H2OÖŠĶŌŖĖŲ»ÆŗĻ¼Ū“Ó0¼ŪÉżøßµ½+2¼Ū£¬Ķ»¹Ō¼Į”£µŖŌŖĖŲ»ÆŗĻ¼Ū“Ó+5¼Ū½µµĶµ½+2¼Ū£¬µĆµ½3øöµē×Ó£¬ĻõĖįŹĒŃõ»Æ¼Į”£øł¾Żµē×ӵƏ§ŹŲŗćæÉÖŖ»¹Ō¼ĮÓėŃõ»Æ¼ĮµÄĪļÖŹµÄĮæÖ®±Č3:2£¬µ±ÓŠ0.6molµē×Ó×ŖŅĘŹ±Éś³ÉµÄNOŹĒ0.6mol”Ā3£½0.2mol£¬ŌŚ±ź×¼×“æöµÄĢå»żĪŖ0.2mol”Į22.4L/mol£½4.48L”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŅ¶žĖį¶žŅŅõ„£ØD£©æÉÓÉŹÆÓĶĘųĮŃ½āµĆµ½µÄĻ©ĢžŗĻ³É”£»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©BŗĶAĪŖĶ¬ĻµĪļ£¬BµÄ½į¹¹¼ņŹ½ĪŖ_______”£
£Ø2£©·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½ĪŖ___________£¬Ęä·“Ó¦ĄąŠĶĪŖ__________”£
£Ø3£©·“Ó¦¢ŪµÄ·“Ó¦ĄąŠĶĪŖ____________”£
£Ø4£©CµÄ½į¹¹¼ņŹ½ĪŖ___________”£
£Ø5£©·“Ó¦¢ŚµÄ»Æѧ·½³ĢŹ½ĪŖ______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖŃŠ¾æ³ĮµķµÄÉś³É¼°Ęä×Ŗ»Æ£¬Ä³Š”×é½ųŠŠČēĻĀŹµŃ飮¹ŲÓŚøĆŹµŃéµÄ·ÖĪö²»ÕżČ·µÄŹĒ£Ø””””£©

A. ¢Ł×ĒŅŗÖŠ“ęŌŚĘ½ŗā£ŗAgSCN£Øs£©Ag+£Øaq£©+SCN-£Øaq£©
B. ¢ŚÖŠŃÕÉ«±ä»ÆĖµĆ÷ÉĻ²ćĒåŅŗÖŠŗ¬ÓŠSCN-
C. øĆŹµŃéæÉŅŌÖ¤Ć÷AgI±ČAgSCNøüÄŃČÜ
D. ¢ŪÖŠŃÕÉ«±ä»ÆĖµĆ÷ÓŠAgIÉś³É
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĄė×ÓÄÜ“óĮæ¹²“ęµÄŹĒ
A.NH4+”¢K£«”¢OH£”¢NO3£B.Mg2£«”¢Na£«”¢Cl£”¢SO42-
C.K+”¢H£«”¢Cl£”¢HCO3£D.Fe2+”¢Ca2£«”¢I-”¢CO 32£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬ŌŚČżøöČŻ»ż¾łĪŖ 1.0 L µÄŗćČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗCH3OH(g)+CO(g) CH3COOH(g) ¦¤H<0”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
ČŻĘ÷±ąŗÅ | ĪĀ¶Č/K | ĪļÖŹµÄĘšŹ¼ÅضČ/mol/L | ĪļÖŹµÄĘ½ŗāÅضČ/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. “ļĘ½ŗāŹ±£¬ČŻĘ÷ I ÓėČŻĘ÷ II ÖŠµÄ×ÜŃ¹ĒæÖ®±ČĪŖ 3 : 4
B. “ļĘ½ŗāŹ±£¬ČŻĘ÷ II ÖŠ ![]() ±ČČŻĘ÷ I ÖŠµÄŠ”
±ČČŻĘ÷ I ÖŠµÄŠ”
C. “ļĘ½ŗāŹ±£¬ČŻĘ÷¢óÖŠµÄÕż·“Ó¦ĖŁĀŹ±ČČŻĘ÷ I ÖŠµÄ“ó
D. “ļĘ½ŗāŹ±£¬ČŻĘ÷ I ÖŠCH3OH ×Ŗ»ÆĀŹÓėČŻĘ÷ III ÖŠ CH3COOH ×Ŗ»ÆĀŹÖ®ŗĶŠ”ÓŚ 1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÕżŌŚŃŠ·¢µÄļ®æÕĘųµē³ŲÄÜĮæĆܶČøß”¢³É±¾µĶ£¬æÉ×÷ĪŖĪ“Ą“µē¶ÆĘū³µµÄ¶ÆĮ¦Ō“£¬Ę乤×÷ŌĄķČēĶ¼”£ĻĀĮŠÓŠ¹ŲøƵē³ŲµÄĖµ·ØÕżČ·µÄŹĒ
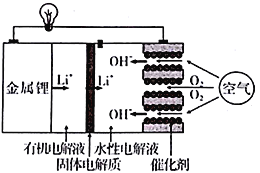
A. ÓŠ»śµē½āŅŗæÉŅŌ»»³ÉĖ®ŠŌµē½āŅŗ
B. ·ÅµēŹ±£¬ĶāµēĀ·Ķعż2 mol µē×Ó£¬ĻūŗÄŃõĘų11.2 L
C. ·ÅµēŗĶ³äµēŹ±£¬Li+ĒØŅĘ·½ĻņĻąĶ¬
D. µē³Ų³äµēŹ±£¬ŌŚÕż¼«ÉĻ·¢ÉśµÄ·“Ó¦ĪŖ4OH--4e-= O2”ü+2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ĘĶæó(CuFeS2)ŹĒÖŲŅŖµÄæó²Ų£¬ŅŌ»ĘĶæóĪŖŌĮĻÉś²ś¼īŹ½ĀČ»ÆĶŗĶĢśŗģ(Ńõ»ÆĢś)ŃÕĮĻµÄ¹¤ŅÕĮ÷³ĢČēĶ¼ĖłŹ¾”£

£Ø1£©·“Ó¦¢ńµÄĄė×Ó·½³ĢŹ½ĪŖ_____________£¬øĆ·“Ó¦µÄŃõ»Æ¼ĮŹĒ________________”£
£Ø2£©·“Ó¦¢ņµÄĄė×Ó·½³ĢŹ½ĪŖ_________________________”£
£Ø3£©·“Ó¦¢öŹĒŌŚ45~50”ęµÄĢõ¼žĻĀ½ųŠŠµÄ£¬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ__________________”£
£Ø4£©¼īŹ½ĀČ»ÆĶÓŠ¶ąÖÖ×é³É£¬æɱķŹ¾ĪŖCua(OH)bClc”¤xH2O£¬ĪŖ²ā¶Øij¼īŹ½ĀČ»ÆĶµÄ×é³É£¬Ä³ŹµŃ銔×é½ųŠŠĻĀĮŠŹµŃé£ŗ
¢Ł³ĘȔѳʷ9.30g£¬ÓĆÉŁĮæĻ”HNO3ČܽāŗóÅä³É100.00mLČÜŅŗA£»
¢ŚČ”25.00mLČÜŅŗA£¬¼ÓČė×ćĮæAgNO3ČÜŅŗ£¬µĆµ½AgCl¹ĢĢå1.435g£»
¢ŪĮķČ”25.00mLČÜŅŗA£¬µ÷½ŚpHĪŖ4~5£¬ÓĆÅضČĪŖ0.40mol”¤L-1µÄEDTA(Na2H2Y”¤2H2O)±ź×¼ČÜŅŗµĪ¶ØCu2+(Ąė×Ó·½³ĢŹ½ĪŖCu2++H2Y2-=CuY2-+2H+)£¬µĪ¶ØÖĮÖÕµć£¬Ļūŗıź×¼ČÜŅŗ50.00mL”£Ķعż¼ĘĖćČ·¶ØøĆѳʷµÄ»ÆѧŹ½ĪŖ___________(Ģī»ÆѧŹ½)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖŅŗ°±µÄŠŌÖŹÓėĖ®ĻąĖĘ”£T”ꏱ£¬NH3+NH3![]() NH4++NH2-£¬NH4+µÄĘ½ŗāÅضČĪŖ1”Į10-15mol/L£¬ŌņĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ( )
NH4++NH2-£¬NH4+µÄĘ½ŗāÅضČĪŖ1”Į10-15mol/L£¬ŌņĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ( )
A. ŌŚ“ĖĪĀ¶ČĻĀŅŗ°±µÄĄė×Ó»żĪŖ1”Į10-17
B. ŌŚŅŗ°±ÖŠ·ÅČė½šŹōÄĘ£¬æÉÉś³ÉNaNH2
C. ŗćĪĀĻĀ£¬ŌŚŅŗ°±ÖŠ¼ÓČėNH4Cl£¬æÉŹ¹Ņŗ°±µÄĄė×Ó»ż¼õŠ”
D. ½µĪĀ£¬æÉŹ¹Ņŗ°±µēĄėĘ½ŗāÄęĻņŅĘ¶Æ£¬ĒŅc(NH4+)<c(NH2-)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ2A£«3B===2C£«DµÄ·“Ó¦ÖŠ£¬±ķŹ¾·“Ó¦ĖŁĀŹ×īæģµÄŹĒ(””””)
A. v(A)£½0.5 mol”¤L£1”¤min£1B. v(B)£½0.6 mol”¤L£1”¤min£1
C. v(C)£½0.35 mol”¤L£1”¤min£1D. v(D)£½0.4 mol”¤L£1”¤min£1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com