
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用干燥的PH试纸可以确定某气体是否是氨气 | |
| B. | 在含有FeCl2杂质的FeCl3溶液中通入足量Cl2后,充分加热,可得到纯净的FeCl3溶液 | |
| C. | 中和热测定实验中,碱液要一次性加入,以防止热量损失 | |
| D. | 为减小中和滴定误差,锥形瓶必须用待测液润洗后才能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
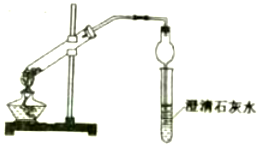 现有两瓶白色固体分别是碳酸钠固体与碳酸氢钠固体,某同学利用多种方法进行鉴别:
现有两瓶白色固体分别是碳酸钠固体与碳酸氢钠固体,某同学利用多种方法进行鉴别:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝中和胃酸:Al(OH)3+3H+═Al3++3H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Na+):n(Cl-) 可能为7:4 | |
| B. | 与NaOH反应的氯气一定为0.1mol | |
| C. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40.75 | B. | 29.38 | C. | 14.69 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验一 | 实验二 | |
| 装置 | 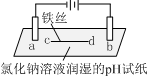 | 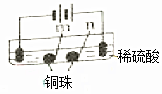 |
| 现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;… |
| A. | a、d处:2H2O+2e-=H2↑+2OH- | |
| B. | b处:2Cl--2e-=Cl2↑ | |
| C. | 根据实验一的原理,实验二中m处能析出铜 | |
| D. | n处发生了反应:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④ | |
| B. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| C. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va:Vb=9:11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com