
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前5min的平均速率为v (SO2)=0.08mol•L-1•min-1 | |
| B. | 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% | |
| C. | 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆) | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
分析 A.根据化学反应速率v=$\frac{△c}{△t}$来计算;
B.可计算平衡常数,根据平衡常数计算;
C.温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,相当于增大压强,根据压强对化学平衡的影响来回答判断;
D.根据B的计算,判断平衡时转化的程度,可计算吸收的热量.
解答 解:A.反应在前5min的平均速率为v (SO2)=$\frac{△c}{△t}$=$\frac{\frac{2-1.2}{2}}{5}$mol/(L•min)=0.08mol•L-1 min-1,故A正确;
B.2SO2(g)+O2(g)?2SO3(g)
初始量:2 1 0
变化量:1.2 0.6 1.2
平衡量:0.8 0.4 1.2
化学平衡常数K=$\frac{(\frac{1.2}{2})^{2}}{(\frac{0.8}{2})^{2}×\frac{0.4}{2}}$=$\frac{45}{4}$
起始时向容器中充入1.5mol SO3,如果转化率是40%,则
2SO2(g)+O2(g)?2SO3(g)
初始量:0 0 0.75
变化量:0.3 0.15 0.3
平衡量:0.3 0.15 0.45
此时K=$\frac{0.4{5}^{2}}{0.{3}^{2}×0.15}$≠$\frac{45}{4}$,故B错误;
C.温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,此时$\frac{0.6{5}^{2}}{0.{5}^{2}×0.15}$>$\frac{45}{4}$,化学平衡正向移动,v(正)>v(逆),故C正确;
D.通过计算,当反应进行到10min时,二氧化硫的物质的量是0.8mol,所以10min就达到化学平衡状态,此时反应放出的热量是0.4×196kJ=78.4kJ,起始时向容器中充入2molSO3,达到的平衡和充入2molSO2以及1molO2建立的平衡是等效的,互为逆反应的过程是吸热的,所以达平衡时吸收78.4kJ的热量,故D正确.
故选B.
点评 本题综合考查化学平衡的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及等效平衡的建立以及化学反应达到平衡时物质的转化率等方面的知识,属于综合知识的考查,难度较大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:实验题
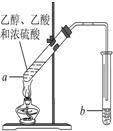 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为18 | |
| B. | 容器②中达到平衡时放出的热量为0.05Q kJ | |
| C. | 向容器①中通入氦气,平衡时A的转化率增大 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | 平衡时A的浓度为1.5 mol/L | |
| C. | B的转化率为20% | |
| D. | 反应起始和达到平衡时,混合气体的压强比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
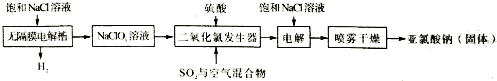
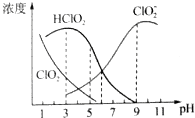
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
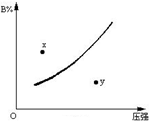 反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | m+n>P | |
| B. | n>p | |
| C. | x点表示该反应的正反应速率小于逆反应速率 | |
| D. | x点比y点时的反应速率慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com