
分析 (1)根据质量分数计算碳酸钙的质量,再根据CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑计算二氧化碳的体积;
碳酸钙分解产生二氧化碳,焦炭完全燃烧也生成二氧化碳,根据碳元素守恒计算焦炭的物质的量;
(2)加入碳酸钠最少时,反应完毕为NaCl溶液,反应过程中氯离子物质的量不变,根据氯离子守恒:n生成(NaCl)=2n(MgCl2)+2n(CaCl2 ),根据钠离子守恒:n生成(NaCl)=2n(Na2CO3 ),再根据m=nM计算Na2CO3 的质量;
加入的碳酸钠除钙离子,溶液中n(Ca2+)=n(Na2CO3),反应中NH3、CO2按物质的量之比2:1反应,而碳酸化尾气中NH3、CO2的物质的量之比为0.1:0.04=2.5:1,故反应中氨气有剩余,根据钙离子物质的量计算二氧化碳的物质的量,结合二氧化碳的体积分数计算碳酸化尾气的体积;
(3)①根据氯离子守恒计算滤液中NaCl物质的量,再根据m=nM计算;
②根据钠离子守恒计算生成碳酸氢钠的物质的量,再根据m=nM计算.
解答 解:(1)碳酸钙的质量为0.90×100kg=90Kg,即质量为90000g,设生成二氧化碳的体积为V,则:
CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑
100g 22.4
90000g V
所以V=$\frac{90000g×22.4L}{100g}$=20160L;
碳酸钙分解产生二氧化碳,焦炭完全燃烧也生成二氧化碳,根据碳元素守恒,焦炭燃烧生成的二氧化碳为29120L-20160L=8960L,焦炭与其燃烧生成的二氧化碳物质的量相等,故需要焦炭的物质的量为$\frac{8960L}{22.4L/mol}$=400mol,
故答案为:20160;400;
(2)加入碳酸钠最少时,反应完毕为NaCl溶液,反应过程中氯离子物质的量不变,
根据氯离子守恒:n生成(NaCl)=2n(MgCl2)+2n(CaCl2 )=10m3×6.80mol/m3×2+10m3×3.00mol/m3×2=196mol,根据钠离子守恒:n生成(NaCl)=2n(Na2CO3 ),故n(Na2CO3 )=$\frac{196mol}{2}$=98mol,故需要Na2CO3 的最少质量为98mol×106g/mol=10388g;
加入的碳酸钠除钙离子,溶液中n(Ca2+)=n(Na2CO3)=98mol,反应中NH3、CO2按物质的量之比2:1反应,而碳酸化尾气中NH3、CO2的物质的量之比为0.1:0.04=2.5:1,故反应中氨气有剩余,根据Ca2++2NH3+CO2+H2O→CaCO3↓+2NH4+,可知需要二氧化碳为98mol,故需要碳酸化尾气的体积为98mol×22.4L/mol÷0.04=54880L,
故答案为:10388;54880L;
(3)反应方程式为:NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓,
①原溶液中氯化钠的物质的量为$\frac{1521×1000g}{58.5g/mol}$=26×1000mol,滤液中氯化铵的物质的量为$\frac{1070×1000g}{53.5g/mol}$=20×1000mol,根据氯离子守恒,滤液中NaCl物质的量为26×1000mol-20×1000mol=6×1000mol,则过滤后溶液中氯化钠的质量为6×1000mol×58.5g/mol=351×1000g,即为351kg,
答:过滤后溶液中氯化钠的质量为351kg;
②根据钠离子守恒,生成碳酸氢钠的物质的量为26×1000mol-6×1000mol=20×1000mol,则析出碳酸氢钠的质量为20×1000mol×84g/mol=1680×1000g,即为1680kg,
答:析出碳酸氢钠的质量为1680kg.
点评 本题考查混合物的有关计算,注意利用守恒法进行计算解答,侧重考查学生的分析计算能力,题目过程复杂、计算量大,为易错题目,难度中等.


科目:高中化学 来源: 题型:选择题
 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①③⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2OH | B. |  | C. | 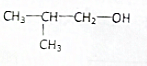 | D. | 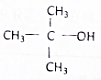 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
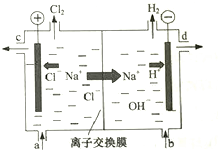 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
① SO2; ② CH3CH2CH=CH2; ③ 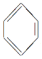 ; ④ CH3CH3。
; ④ CH3CH3。
A.①②③④ B.①② C.①②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
有关乙烯的下列叙述:① 乙烯溶于水后可得乙醇;② 乙烯能发生加聚反应;③ 乙烯能与溴水发生加成反应;④ 乙烯是无色、稍有气味、难溶于水的气体;其中正确的是( )
A.全部 B.①和③ C.②和③ D.②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:H+ + HCO3-  H2CO3
H2CO3  CO2 + H2O。故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是( )
CO2 + H2O。故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是( )
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0、△S<0
B.使用催化剂能够降低化学反应的反应热(△H)
C.由Ka(HCN)<Ka(CH3COOH)可说明在相同条件下,氢氰酸的酸性比醋酸弱
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com