
【题目】配制一定物质的量浓度的溶液时,下列操作会使所配得的溶液物质的量浓度偏高的是 ( )
A. 省去洗涤烧杯的步骤
B. 定容时俯视刻度
C. 定容时仰视刻度
D. 定容、摇匀、静置后发现凹液面低于刻度线又加水至刻度
科目:高中化学 来源: 题型:
【题目】冬季是雾霾大气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(l)工业上利用甲烷催化还原NOx可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为__________________。
(2)将CO2转化为甲醇可以实现废物利用,达到节能减排的目的,反应原理可表示为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①在一恒温恒容密闭容器中充入1molCO2和3molH2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。请回答:
0~3min内氢气的平均反应速率为______mol/(L·min);
第10min后,保持温度不变,向该密闭容器中再充入1molCO2(g)和3molH2 (g),则达到平衡时CH3OH的体积分数_________(填“增大”、“减小”或“不变”)。

②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3___0(填“>”、“<”或“=”)。
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率σ随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率σ随温度、投料比![]() 的变化曲线如图3所示。
的变化曲线如图3所示。
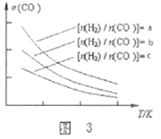
①a、b、c按从大到小的顺序排序为___________。
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=________________。
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是______。
A.逆反应速率先增大后减小B.混合气体的密度增大
C.化学平衡常数K值减小D.氢气的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如右图。下列关于它的说法正确的是
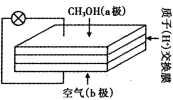
A. 电子自b极经外电路流向a极
B. b极的电极反应式为O2 +4e - +4H+= 2H2O
C. 质子交换膜中的H+流向a极
D. 用该电池电解CuSO4溶液,理论上每生成0.1 molCu消耗氧气1.12 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学镀银法是非金属表面镀银的常用方法。下图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):
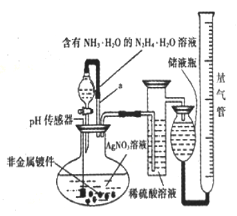
化学镀银中的反应如下:
I:4AgNO3+N2H4·H2O=4Ag↓+N2↑+4HNO3+H2O
Ⅱ:NH3·H2O + HNO3=NH4NO3+H2O
Ⅲ:Ag++2 NH3·H2O= [Ag(NH3)2]++2H2O
(1)写出N2H4的电子式______________。已知稀硝酸的氧化性强于Ag+,N2H4·H2O中加适量氨水的一个重要目的是控制溶液的pH在8~9之间。筒述溶液不能呈酸性的理由___________。
(2)带有导管a的分液漏斗叫恒压漏斗,下列关于恒压漏斗在该实验中的作用说法正确的是____(填选项字母)。
A.防止稀硫酸倒吸进入圆底烧瓶
B.使漏斗中液体顺利流下
C.减小加入液体体积对测量气体体积的误差
D.方便检验装置的气密性
(3)银膜是否均匀致密的关键在于“沉银”速率控制,一般速率越慢,银膜越均匀越致密。简述加入氨水的另外一个目的________。
(4)未被还原的Ag+占总银元素质量比(ψ1)叫非还原损耗,被还原但是没有在镀件上附着沉淀的银占总银元素质量比(ψ2)叫还原损耗。实验中用200 mL 0.100 mol/L AgNO3溶液,加过量的N2H4·H2O,测得相关数据如下:
I:非金属镀件镀前质量为20. 000克,镀后质量(已清洗干燥)为21. 728克;
Ⅱ:量气管收集到的气体折算标准状况体积为106. 400 mL。
则ψ1= __________;ψ2=____________。
(5)化学镀银中常用次磷酸钠(NaH2PO2)做还原剂,已知该反应的氧化产物为磷酸,写出该反应的离子反应方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g) ![]() 2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A. 生成C的速率与A的消耗的速率相等
B. A、B、C的浓度相等
C. 单位时间生成n mol A,同时生成 2n mol C
D. A、B、C的分子数之比为 1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】游离态的氮经一系列转化可以得到硝酸,如下图所示。
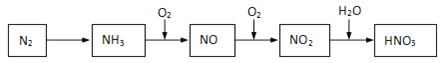
(1)NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为________________。
(3)2NO(g)+O2(g) ![]() 2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。

①2min内,v(O2)=________mol/(L·min)
②800℃时,该反应的化学平衡常数为__________。
③判断该反应达到平衡的依据是(写出2条即可)____________。
④已知:ⅰ.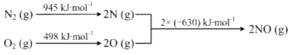
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式_____________,温度对于NO生成NO2平衡转化率的影响是:___________________。
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:______________。
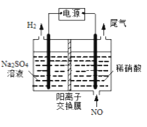
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)![]() 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1计算:
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1计算:
(1)v(C)等于多少?
(2)z的值。
(3)B的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2O和Na2O2的叙述正确的是( )
A. Na2O与Na2O2颜色相同 B. 均可与CO2、H2O反应产生氧气
C. 阴、阳离子的个数比均为1∶2 D. 所含氧元素的化合价均为-2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com