

分析 (1)利用均摊法计算晶胞中Fe原子数目,进而计算Fe原子总体积,位于体对角线上的Fe原子相邻,据此计算晶胞的棱长,进而计算晶胞体积,空间利用率=$\frac{原子总体积}{晶胞体积}$×100%;
(2)①根据图示的晶胞结构判断钙离子、氟离子的配位数;
②根据均摊法计算每个氟化钙晶胞中平均拥有Ca2+、F-的数目;
③每个氟离子与最邻近的钙离子分布在晶胞的顶点和经过该顶点的三个面的面心上,据此判断.
解答 解:(1)体心立方中含有Fe原子数目为1+8×$\frac{1}{8}$=2个铁原子,设铁原子半径为r,晶胞中铁原子的体积为:2×$\frac{4}{3}$×π×r3,体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为:$\frac{4r}{\sqrt{3}}$,晶胞体积为:($\frac{4r}{\sqrt{3}}$)3,空间利用率为:[(2×$\frac{4}{3}$×π×r3)÷($\frac{4}{\sqrt{3}}$r)3]×100%=68%,
故答案为:[(2×$\frac{4}{3}$×π×r3)÷($\frac{4}{\sqrt{3}}$r)3]×100%;68;
(2)①在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8;在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4,
故答案为:8;4;
②根据均摊法,该晶胞中含有钙离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氟离子在该晶胞的内部,所以氟离子个数是8,
故答案为:4;8;
③每个氟离子与最邻近的钙离子分布在晶胞的顶点和经过该顶点的三个面的面心上,所以氟离子与最邻近的钙离子构成正四面体,
故答案为:正四面体.
点评 本题考查物质结构与性质,涉及元素性质递变规律、等电子原理应用、分子性质、配位键、晶胞计算,(4)中计算为易错点、难点,需要学生具备一定的数学计算能力,题目难度中等.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
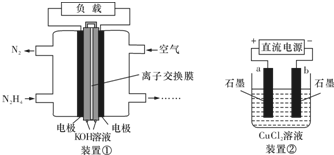
| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2↑+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4 | |
| C. | 该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Cl-、NH4+、AlO2-、SO42- | |
| B. | 常温下,pH=14的溶液中:CO32-、Na+、S2-、AlO2- | |
| C. | 室温下,水电离出的c(OH-)=10-13mol•L-1的溶液中:K+、HCO3-、Br-、Ba2+ | |
| D. | 使甲基橙变红的溶液中:Fe2+、Al3+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnCl2[ZnSO4] | B. | NaOH[H2O] | C. | CuCl2[HCl] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加酸性高锰酸钾溶液,后加银氨溶液,微热 | |
| B. | 先加溴水,后加酸性高锰酸钾溶液 | |
| C. | 先加银氨溶液,微热,再加入溴水 | |
| D. | 先加入新制氢氧化铜,微热.酸化后再加溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该物质属于两性氢氧化物 | |
| B. | 该物质是Al(OH)3和Na2CO3的混合物 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗4mol H+ | |
| D. | 1mol NaAl(OH)2CO3最多可消耗4mol H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com