
 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.| t/℃ | 25 | 125 | 225 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
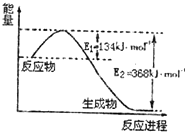
分析 (1)根据能量变化图,反应热等于=正反应的活化能减去逆反应的活化能,结合热化学方程式的书写规则书写;
(2)①根据焓变判断生成物反应物浓度的变化,然后根据平衡常数判断;
②根据平衡状态的判断依据判断,平衡标志最根本的依据是正反应速率等于逆反应速率,反应混合物中各组分的含量保持不变.
解答 解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;
(2)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,
故答案为:>;
②A、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,能证明正逆反应速率相等,故A正确;
B、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3vNH3(正)=2vH2(正)不是平衡状态,故B错误;
C、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故C正确;
D、N2(g)+3H2(g)?2NH3(g)△H<0,该反应反应物生成物全部为气体,如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故D错误;
故选:AC.
点评 本题考查热化学方程式书写方法,反应热的计算,化学平衡的分析判断和化学平衡移动的判断,反应热的计算注意图象的分析应用,题目难度中等.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
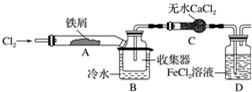 FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
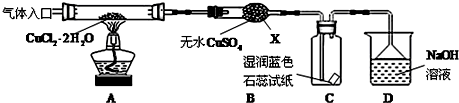
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.10 | 26.11 | 26.01 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com