

| A. | 吸收塔中的硫元素可能以单质形式存在 | |
| B. | 中和池中只发生生成沉淀的复分解反应 | |
| C. | 在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀 | |
| D. | 由题意分析得到,沉淀可能是Cr(OH)6 |
分析 吸收塔中二氧化硫与Cr2O72-离子发生氧化还原反应:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,在中和池中氢氧化钠与酸的中和反应、氢氧根离子与Cr3+离子生成是Cr(OH)3沉淀,Cr(OH)3加热分解得到Cr2O3.
解答 解:吸收塔中二氧化硫与Cr2O72-离子发生氧化还原反应:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,在中和池中氢氧化钠与酸的中和反应、氢氧根离子与Cr3+离子生成是Cr(OH)3沉淀,Cr(OH)3加热分解得到Cr2O3.
A.反应中Cr元素化合价降低,根据电子转移守恒,S元素化合价升高,不可能以S元素不可能以单质形式存在,反应生成SO42-,故A错误;
B.中和池中出来发生生成沉淀的复分解反应外,还发生酸碱中和反应,故B错误;
C.中和池中反应后的溶液中含有SO42-,加入盐酸酸化的BaCl2溶液,可能产生硫酸钡白色沉淀,故C正确;
D.由上述分析可知,得到的沉淀为Cr(OH)3,故D错误,
故选:C.
点评 本题考查化学工艺流程、对原理的分析评价等,明确工艺流程原理是解题关键,侧重考查了学生的分析理解、知识迁移运用能力,题目体现的化学在生活、生产中的应用,难度中等.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Zn为正极,Ag2O为负极 | |
| B. | Zn为负极,Ag2O为正极 | |
| C. | 原电池工作时,正极区溶液pH值减小 | |
| D. | 原电池工作时,负极区溶液pH值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
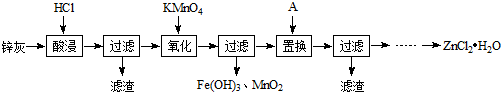
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
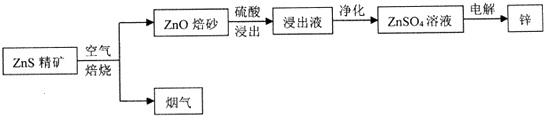
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
| 表1 | |||
| 编号 | 1 | 2 | 3 | 4 | |
| 盐酸体积/mL | 25.05 | 25.00 | 26.80 | 24.95 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )| A. | 3.6g | B. | 4g | C. | 4.4g | D. | 4.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮分子为非极性分子 | |
| B. | 在灯泡中充入氮气可防止钨丝被氧化 | |
| C. | 氮元素比磷元素非金属性强,所以硝酸比磷酸酸性强 | |
| D. | 氮分子中有2个σ键1个π键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com