
| A、H2S |
| B、CH3COONH4 |
| C、Cu |
| D、NH3?H2O |
科目:高中化学 来源: 题型:
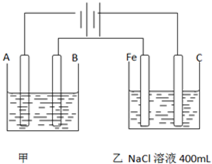 如图所示,外接电源为Zn-MnO2干电池,甲乙为相互串联的两个电解池,请回答:
如图所示,外接电源为Zn-MnO2干电池,甲乙为相互串联的两个电解池,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、HCO3-、Cl-、SO42- |
| B、Al3+、K+、SO42-、Cl- |
| C、Fe2+、NH4+、SO42-、K+ |
| D、Mg2+、ClO-、OH-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铜溶于醋酸溶液中:Cu(OH)2+2H+═Cu2++2H2O | |||
B、乙醛的银镜反应:CH3CHO+Ag(NH3)2OH
| |||
| C、苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |||
D、丙烯聚合:nCH2=CHCH3
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时刻/s | t1 | t2 | t3 | t4 |
| n(A)/mol | 7 | 3 | 1 | 1 |
| n(B)/mol | 5 | 3 | 2 | 2 |
| n(C)/mol | 1 | 3 | 4 | 4 |
| A、在容器中发生的反应为:2A+B?C |
| B、平衡时A的转化率比B的转化率高 |
| C、在该温度下该反应的化学平衡常数K=200 |
| D、在t1~t2内C物质的平均反应速率为[2/(t2-t1)]mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和③ | B、③和⑤ |
| C、④和⑤ | D、②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成物总能量大于反应物总能量,该反应为放热反应 |
| B、一个化学反应需要加热才能进行,该反应为吸热反应 |
| C、应用盖斯定律,可计算某些难以直接测量的化学反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com