
A、相同条件下,结合质子的能力:OH->AlO2->CO32->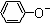 >HCO3->CH3COO- >HCO3->CH3COO- |
B、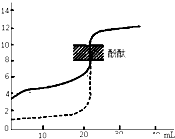 如图表示用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率,平衡常数保持不变 |
| D、恒容密闭容器中进行的反应A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
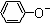 >HCO3->CH3COO-,故A正确;
>HCO3->CH3COO-,故A正确;

科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进入人体的重金属盐能使蛋白质变性,所以会使人中毒 |
| B、卤代烃C4H8Cl2有四种同分异构体 |
| C、甲烷是天然气的主要成分,能发生加成反应 |
| D、用驴皮熬制成的胶(阿胶)是一种天然橡胶,属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
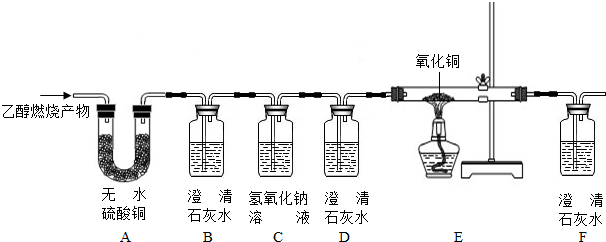
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5NA | ||||||||||
| B、一定温度下,氯化铵水解离子方程式:NH+4+H2O?NH3?H2O+H+,若用KW表示的离子积,Kb表示氨水电离常数,则氯化铵水解平衡常数K=KW/Kb | ||||||||||
| C、已知反应:2Fe3++2I-=2Fe2++I2:2Co(OH)3+2Cl-+6H+=2Co2++Cl2↑+6H2O:2Fe(OH)2+I2+2OH-=2Fe(OH)3+2I-;则在酸性溶液中氧化性:Fe3+>Co(OH)3>I2 | ||||||||||
D、已知
|
查看答案和解析>>
科目:高中化学 来源: 题型:
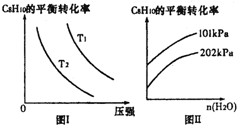 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
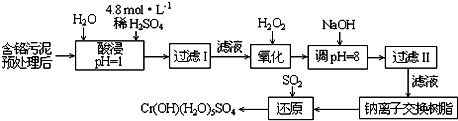
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
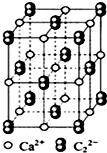 CaC2可用于固氮:CaC2+N2
CaC2可用于固氮:CaC2+N2
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com