氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
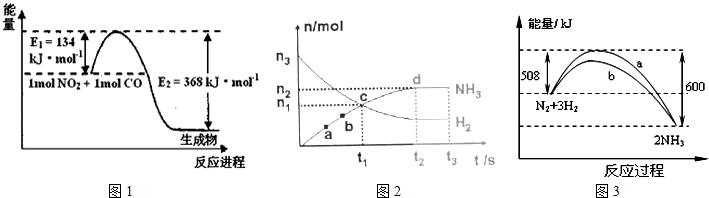
(1)如图1是1mol NO
2和1mol CO反应生成CO
2和NO过程中能量变化示意图,请写出NO
2和CO反应的热化学方程式
.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N
2(g)+3H
2(g)?2NH
3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题.
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
①试比较K
1,K
2的大小,K
1
K
2(填写“>”、“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是_
(填序号字母):
a.容器内N
2.H
2.NH
3的浓度之比为1:3:2 b.v(N
2)
正=3v(H
2)
逆c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得NH
3和N
2、H
2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N
2)
正
v(N
2)
逆(填写“>”、“=”或“<”)
(3)一定条件下,在体积为VL的密闭容器中进行反应:N
2(g)+3H
2(g)?2NH
3(g),其n(H
2)和n(NH
3)随时间变化的关系如图2所示.从开始到平衡时,反应的平均速率用H
2的浓度变化表示为v(H
2)=
.
(4)在一定温度时,N
2与H
2反应过程中能量变化的曲线如图3所示,下列叙述正确的是
A.逆反应的活化能不小于92kJ/mol B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应放热增多 D.加入催化剂可增大正反应速率,降低逆反应速率.








