
【题目】下列物质中可用于治疗胃酸过多的是
A.碳酸钠B.氢氧化铝C.氧化钙D.硫酸钡
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列做法符合“绿色化学”思想的是( )
A. 回收利用废旧电池
B. 用燃气热水器代替太阳能热水器
C. 将实验室的有机废液直接倒入下水道
D. 在通风橱中制取SO2不用NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
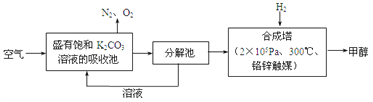
(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400 g CO2与足量H2完全反应,生成气态的H2O和气态甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________。
(3)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:
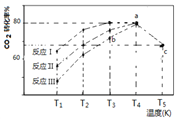
(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________。
④c点时该反应的平衡常数K =____________________。
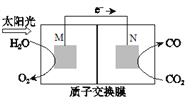
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能比较次氯酸与醋酸的酸性强弱的是
A. 0.10 mol·L-1的次氯酸和醋酸的pH分别为4.8和3.1
B. 次氯酸的导电能力低于相同浓度的醋酸
C. 醋酸的稳定性强于次氯酸
D. 次氯酸不能与碳酸氢钠溶液反应,而醋酸可以
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和H2S会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
(1)用氨水除去SO2:
已知 25℃,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8,NH3·H2O的 Kb=1.8×l0-5。
①试写出H2SO3在水溶液中的电离方程式__________________,从电离平衡的角度解释Ka1、Ka2差别很大的原因_________________。
②若氨水的浓度为0.02 mol·L-1,溶液中的c(OH-)=____________mol·L-1、将SO2通入该氨水中,当溶液中的c(SO32-)/ c(HSO3-)=6.2时,溶液的pH=_____________。
(2)生物脱H2S:
原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O
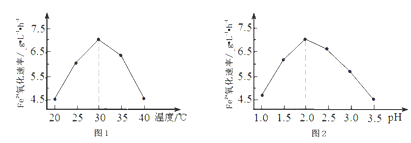
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______________ 。
②由图1和图2判断使用硫杆菌的最佳条件为________________ ,若反应温度过高,反应速率下降,其原因是__________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法. 已知:温度过高过氧化钙会分解生成氧化物和氧气.
【方法1】由Ca(OH)2为原料最终制得,其制备流程如下: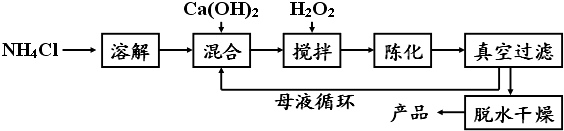
【方法2】由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下: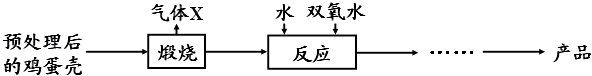
(1)方法1中搅拌的目的是;请将搅拌过程中发生反应的化学方程式补充完整:CaCl2+H2O2+2NH3H2O+6═CaO28H2O↓+2NH4Cl;制备过程中除水外可循环使用的物质是(填化学式).
(2)方法2中气体X是 , 实验室常用溶液来检验;煅烧后的反应是化合反应,也能生成CaO28H2O,反应的化学方程式为;该反应需控制温度在0~2℃,可将反应器放置在中,获得CaO2产品中主要含有的固体杂质是(填化学式).
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高除了防止氨水挥发外,还能
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO28H2O的反应符合“绿色化学”的是(填“方法1”或“方法2”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com