
����Ŀ�����Ȼ��������������Ѽ��仯�������Ҫ�м��塣ijУ��ѧ����С����������ͼװ���Ʊ����Ȼ���(���ּг���������ȥ)��

���ϱ����������£����Ȼ���Ϊ��ɫҺ�壬�۵㣺��25 �����е㣺136.4 �����ڿ����з������ɶ������ѹ��塣��650��850 ���£�������ͨ���������Ѻ�̿�۵Ļ����ɵõ����Ȼ��Ѻ�һ���ж����塣�ش��������⣺
��1��A����Һ©���Ϸ��Ľ�Ƥ�ܵ�������______________________________________��
��2��ʵ����Bװ����ѡ�õ��Լ�Ϊ________����װ�õ�������___________________��
��3��д��D�������Ʊ��Ļ�ѧ����ʽ_______________________________________��д�����Ȼ����ڿ����з��̵Ļ�ѧ����ʽ_________________________________��
��4��E�����������ܵ�������____________________________________________����װ����ȴˮӦ��________(����c������d��)��ͨ�롣
��5������F��ʢװ��������________��
��6����ʵ���������ȱ�ݣ���ָ���䲻��֮��__________________________________��
���𰸡� ƽ����ѹ��������Һ��˳������ ����ʳ��ˮ ϴȥCl2�е�HCl���壬��������ȫƿ(������ƽ����ѹ�İ�ȫװ�ã��������������İ�ȫװ��) TiO2��2Cl2��2C![]() TiCl4��2CO TiCl4��2H2O===TiO2��4HCl�� �������� c ��ʯ�� û�ж�CO����β������
TiCl4��2CO TiCl4��2H2O===TiO2��4HCl�� �������� c ��ʯ�� û�ж�CO����β������
����������1��A����Һ©���Ϸ��Ľ�Ƥ�ܿ���ʹ����ѹǿ�����ƽ����ѹ��������Һ��˳�����¡���2�����ɵ������к����Ȼ�������ʵ����Bװ����ѡ�õ��Լ�Ϊ����ʳ��ˮ��������ϴȥCl2�е�HCl����������Ϊ����һ�������������ͨ��������һ��������������ȫƿ(������ƽ����ѹ�İ�ȫװ�ã��������������İ�ȫװ��)����3����650��850 ���£�������ͨ���������Ѻ�̿�۵Ļ����ɵõ����Ȼ��Ѻ�һ���ж����壬����ԭ���غ���ж��ж�������CO����D�������Ʊ��Ļ�ѧ����ʽΪTiO2��2Cl2��2C![]() TiCl4��2CO�����Ȼ����ڿ����з�����˵�����Ȼ�����������������е�ˮ����ˮ�ⷴӦ����Ӧ�Ļ�ѧ����ʽΪTiCl4��2H2O===TiO2��4HCl������4��E�����������ܵ�������������������ȴˮӦ����������ȴ�����װ����ȴˮӦ��c��ͨ�롣��5�����������Ȼ�����������е�ˮ������Ӧ��������F��ʢװ�����������տ����е�ˮ�����Լ�ʣ������������Կ����Ǽ�ʯ������6��CO���ж����壬���Ը�ʵ����Ƶ�ȱ����û�ж�CO����β��������
TiCl4��2CO�����Ȼ����ڿ����з�����˵�����Ȼ�����������������е�ˮ����ˮ�ⷴӦ����Ӧ�Ļ�ѧ����ʽΪTiCl4��2H2O===TiO2��4HCl������4��E�����������ܵ�������������������ȴˮӦ����������ȴ�����װ����ȴˮӦ��c��ͨ�롣��5�����������Ȼ�����������е�ˮ������Ӧ��������F��ʢװ�����������տ����е�ˮ�����Լ�ʣ������������Կ����Ǽ�ʯ������6��CO���ж����壬���Ը�ʵ����Ƶ�ȱ����û�ж�CO����β��������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij��Ӧ��ƽ�⣬ƽ�ⳣ�� ![]() ������ʱ���¶����ߣ�H2Ũ�ȼ�С������˵����ȷ���ǣ� ��
������ʱ���¶����ߣ�H2Ũ�ȼ�С������˵����ȷ���ǣ� ��
A.�÷�Ӧ���ʱ�Ϊ��ֵ
B.���º����£�����ѹǿ��H2Ũ��һ����С
C.�����¶ȣ��淴Ӧ���ʼ�С
D.�÷�Ӧ�Ļ�ѧ����ʽΪCO+H2OCO2+H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ΪV L�ĺ����ܱ�������ʢ��һ����H2 �� ͨ��Br2��g��������ӦH2��g��+Br2��g��2HBr��g����H��0�����¶ȷֱ�ΪT1��T2 �� ƽ��ʱ��H2�����������Br2��g�������ʵ����仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ� �� 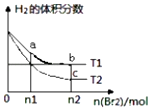
A.��b��c�����ƽ�ⳣ���ֱ�ΪK1��K2 �� ��K1��K2
B.a��b����ķ�Ӧ���ʣ�b��a
C.Ϊ�����Br2��g����ת���ʿɲ�ȡ����Br2��g��ͨ�����ķ���
D.b��c�����HBr���������b��c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش���������
����һ�ָ���ȼ�ϣ��Ѿ������ۼ����ܣ����ѻ��γ�1mol���ۼ�ʱ���ջ��ͷŵ����������£�
N��N | O=O | N��N | N��H | O��H | |
���ܣ�KJmol��1�� | 946 | 497 | 154 | 391 | 463 |
��1��N2H4��g��+O2��g��N2��g��+2H2O��l����H=KJmol��1
��2�����ܱ������н��з�Ӧ��3Fe��s��+4H2O��g��Fe3O4��s��+4H2��g����H��02��Ӧ�Ļ�ѧƽ�����ʽΪK= ��
��3����֪��600��ʱ��������Ӧ��ƽ�ⳣ��K=16��������ͼ1�ף����º�ѹ������ͼ1�ң����º��ݣ�����������ʼʱ���±���ʾ�ֱ��������ʣ����Ϊ2L����600��ʱ��Ӧ����һ��ʱ������ƽ�⣮
Fe | H2O��g�� | Fe3O4 | H2 | |
��/mol | 2.0 | 1.0 | 2.0 | 0.5 |
��/mol | 2.0 | 2.0 | 2.0 | 1.0 |
�ٹ��ڼס�������������˵����ȷ����
A����Ӧ��ʼʱ�������ڵ��淴Ӧ���ʣ��ף���
B������������������ܶȲ��ٱ仯����˵����Ӧ�Ѵﵽƽ��״̬
C�����������������ѹǿ���ٱ仯����˵����Ӧ�Ѵﵽƽ��״̬
D��ƽ�������Fe3O4 �� �������ڵ�ƽ��������ƶ�
��Ͷ�Ϻ��5min��ƽ�⣬��˶�ʱ���ڵ�ƽ����Ӧ����v��H2��=
��ƽ���������������ϵ�¶�ͻȻ����100�棬��ͼ2����ͼ��������ȷ��ӳƽ���ƶ������������ڱ仯������� ��
��4��Ϊ���ݾ�������������������Ӧ����ʼ��ƽ��ʱ�ĸ����ʵ������±���
Fe | H2O��g�� | Fe3O4 | H2 | |
��ʼ/mol | 3.0 | 3.0 | 0 | 0 |
ƽ��/mol | m | n | p | q |
���ڴﵽƽ�����������У��ֱ�������A��B��C��������������Ӹ����ʣ����ٴδ�ƽ��ʱ����������H2�İٷֺ������ɴ�С��˳������A��B��C��ʾ����
Fe | H2O��g�� | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
25��ʱ��Fe��OH��3��ksp=4��10��38 �� ���������ữ��0.08mol/L��FeCl3��Һ����PH=1�������м���������mol/L��NaOH��Һ����ǡ�ÿ�ʼ�������������ʱ��Һ�����ֱ�ӼӺͣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ѧ��ѧʵ���ҵij���ҩƷ���ش�����ʵ�����⡣
��.����һ�����ʵ���Ũ�ȵ�������Һ��
(1)ij��ʵ���Լ��Ҫ1mol/L������Һ435ml��ͬѧ�Ƿ���ʵ������û��450ml������ƿ��ijͬѧ������1��200ml����ƿ��1��250ml����ƿ�����ƣ�����Ϊ������_________(����������������������)��
(2)ʵ����Ҫ����0.5mol/L H2SO4��Һ250ml��������ȡ�ܶ�Ϊ1.84g/ml��98%��Ũ����________ml��

��.������Ũ�����̿��ʵ�������������д̼�����ζ�����壬��Ի��������Ⱦ��ijʵ��С����������װ�öԸ�ʵ����иĽ����ش��������⣺
ע��Ӳ�ʲ������Т��������۴��ֱ�Ϊ����Na2S��Һ����ֽ������Ʒ����Һ����ֽ����������KMnO4��Һ����ֽ��a��b�ֱ�Ϊ����С����
(1)ͼ��ʢװŨ�������������Ϊ________________��
(2)ʵ�鿪ʼ���ȹرջ���K��Ӳ�ʲ������Тٺ���ֽ��ƣ��ںź͢ۺ���ֽ����ɫ��a��������Ӳ�ʲ�������ʵ������˵��̿��ʵ������Ĵ̼�����ζ������SO2�����������۴������ı仯�ֱ�˵��SO2����_____________��_____________��_____________(��SO2���ֳ�������)��
(3)����K��a�������С��b��������ʹ������ƿ�����建��ͨ��Bƿ��Cƿ��һ��ʱ��֮���ֳ���ʯ��ˮ����ǡ�Ϊ֤����CO2���ɣ������ڢܺ�λ�õ���ֽ�μ�______________��Һ�����Լ���������_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����32.64 gͭ��140 mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ������NO��NO2��������ڱ�״���µ����Ϊ11.2 L����ش𣺣�Ҫд������̣�
(1)NO�����Ϊ _L��NO2�����Ϊ _L��������2λ��Ч���֣�
(2)������������ȫ���ͷź�����Һ�м���V mL a mol��L��1��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2�� ȫ��ת���ɳ�������ԭ������Һ��Ũ��Ϊ mol��L��1�����г�����ʽ���ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�����������˵������ȷ���ǣ� ��
A.1 mol FeCl3��ˮ��ȫ��Ӧת��Ϊ����������������н������ӵ���ĿΪNA
B.��2H��18O����ɵ�ˮ11 g������������������Ϊ4NA
C.�����¶�ϩ�ͻ�������ɵ�42 g���������Hԭ����Ϊ6NA
D.1 mol FeI2������������Ӧʱת�Ƶĵ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A. ���Ǻ���ѿ�Ǿ�Ϊ˫��
B. ø��һ����и�ѡ������ܵĵ�����
C. ֲ���ͺ�������֬����������ʹBr2/CCl4��ɫ
D. ���ۺ���ά��ˮ������ղ����Ϊ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3��һ�ֺ���Ҫ�����Σ���Ҫ������ˮ����������Ч���á��۸���˵��ŵ㡣��ҵ�Ͽɽ���м���������У�������FeCl2����ͨ��Cl2�������Ʊ�FeCl3��Һ��
��1������״���µ�a L�Ȼ�����������100 gˮ�У��õ�������ܶ�Ϊb g��mL��1�������������ʵ���Ũ����______________________��
��2����100 mL��FeBr2��Һ��ͨ���״����Cl2 3.36 L����Ӧ�����Һ��Cl����Br�������ʵ���Ũ����ȣ���ԭFeBr2��Һ�����ʵ���Ũ��Ϊ__________________��
��3��FeCl3��Һ����������ˮ���侻ˮ��ԭ��Ϊ____________________________________(�����ӷ���ʽ��ʾ)����100 mL 2 mol��L��1��FeCl3��Һ��ˮʱ�����ɾ��о�ˮ���õ�����________(����������������������С����)0.2NA��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com