
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 | 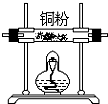 | 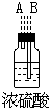 | 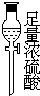 | 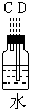 | 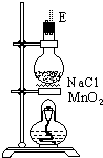 | 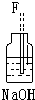 |
分析 (1)仪器的连接方法:先制备反应物,然后除杂质,再使氯气与铜反应,最后尾气处理;进行气体除杂或者干燥时,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用浓硫酸与氯化钠、二氧化锰反生成氯气,除杂后与铜反应生成氯化铜,尾气用氢氧化钠吸收,据此答题;
(2)氯气中的杂质气体氯化氢需要除去,氯化氢极易溶于水,氯气可溶于水;
(3)浓硫酸与氯化钠、二氧化锰加热反生成氯气、氯化锰、硫酸氢钠和水,依据原子守恒和电子守恒配平书写化学方程式;
(4)要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,两性氢氧化物是指和酸、碱都反应的氢氧化物,根据提供的药品可确定还需要的药品;
(5)根据在不同温度下反应物的组成可确定物质的稳定性;
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,是氧化亚铜在酸溶液中发生歧化反应上层硫酸铜和铜;
解答 解:(1)根据题中实验原理,用③中浓硫酸与⑤中氯化钠、二氧化锰加热反生成氯气,通过④中水除去氯气中的氯化氢,除杂后通过②中浓硫酸干燥后,通过①加热与铜反应生成氯化铜,剩余氯气进行尾气吸收,尾气用⑥中氢氧化钠吸收,所以仪器连接顺序为:③⑤④②①⑥,
故答案为:③⑤④②①⑥;
(2)装置⑤中氯化钠和浓硫酸、二氧化锰混合加热反应生成氯气中会混有氯化氢杂质气体,通过装置④中水除去氯气中的氯化氢,
故答案为:除去氯气中混杂的氯化氢气体;
(3)浓硫酸与氯化钠、二氧化锰加热反生成氯气、氯化锰、硫酸氢钠和水,反应的化学方程式为:4NaCl+4 H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+4 NaHSO4+Cl2↑+2H2O,
故答案为:4NaCl+4 H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+4 NaHSO4+Cl2↑+2H2O;
(4)要证明Cu(OH)2具有两性,应先在氯化铜溶液中加入氢氧化钠溶液生成Cu(OH)2,上层的氢氧化铜沉淀中 分别加入酸和碱验证是否溶解,来证明氢氧化铜是否具有两性,所以需要试剂为氢氧化钠溶液,稀硫酸,
故答案为:bc;
(5)氢氧化铜沉淀制得氧化铜粉末,继续加热到1000℃以上,黑色粉末全部变成红色Cu2O粉末,说明在较高温度时Cu2O稳定,+l价的Cu比+2价Cu更稳定,
故答案为:稳定;
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,是氧化亚铜在酸溶液中发生歧化反应上层硫酸铜和铜,反应的离子方程式为:Cu2O+2H+=H2O+Cu2++Cu
故答案为:Cu2O+2H+=H2O+Cu2++Cu.
点评 本题考查了常见气体的制取和收集及实验的注意事项,氯化铜的性质和制取,主要是掌握其选择的依据及原理、验证两性氢氧化物的方法和铜的化合物性质对比,掌握基础是解题关键,题目难度中等,


科目:高中化学 来源: 题型:多选题
| A. | 原混合气体中O2和CH4的体积比为2:1 | |
| B. | 残留物中只有Na2CO3 | |
| C. | 原混合气体中O2和CH4的物质的量之比为1:2 | |
| D. | 残留物只有Na2CO3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 试回答下列问题:
试回答下列问题: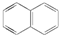 .萘的一氯代物有2种可能的结构,萘的六氯代物有10种可能的结构.
.萘的一氯代物有2种可能的结构,萘的六氯代物有10种可能的结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用溴水鉴别直馏汽油和裂化汽油 | |
| B. | “乙醇汽油”是在汽油里加入适量乙醇而形成的一种燃料,它是一种新型化合物 | |
| C. | 煤的干馏和石油的分馏都是物理变化 | |
| D. | 石油分馏获得的石油气中,含甲烷、乙烷、乙烯等气态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | N、O、F得电子能力依次减弱 | |
| D. | LiOH、NaOH、KOH的碱性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
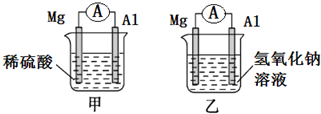 有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com