
| A. | SO2 | B. | CO | C. | CO2 | D. | H2S |
分析 浓硫酸具有酸性,能和碱性气体反应,浓硫酸具有强氧化性,能和强还原性气体反应,不能用浓硫酸干燥说明该气体和浓硫酸反应,据此分析解答.
解答 解:A.虽然浓硫酸具有强氧化性、二氧化硫具有还原性,但二者不能发生氧化还原反应,所以能用浓硫酸干燥二氧化硫,故A不选;
B.CO和浓硫酸不反应,所以能用浓硫酸干燥氢气,故B不选;
C.二氧化碳属于酸性气体,和浓硫酸不反应,所以能用浓硫酸干燥二氧化碳,故C不选;
D.H2S属于还原的酸性气体,能和浓硫酸反应生成单质硫,所以不能用浓硫酸干燥氨气,故D选;
故选D.
点评 本题考查气体的干燥,只要气体和干燥剂不反应的就能用该干燥剂干燥,熟悉常见干燥剂及气体的性质,注意浓硫酸不能干燥硫化氢、碘化氢等气体.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
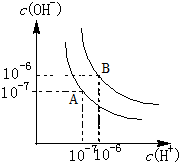 按要求填空:
按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
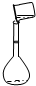 实验室配制250mL 0.100mol/L氯化钠溶液:
实验室配制250mL 0.100mol/L氯化钠溶液:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
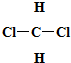 和
和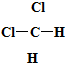 ⑥CH3CH2CH2CH3和
⑥CH3CH2CH2CH3和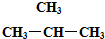
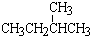 ;
; ③
③ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com